PRINCIPE D’UN RETARDATEUR DE FLAMME
Gérard Gomez
1) Action de l’acide sulfurique
concentré sur la matière organique
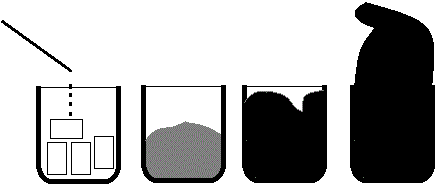
Si l’on verse quelques gouttes d’acide sulfurique
concentré sur quelques morceaux de sucre disposés au fond d’un bécher, on voit
rapidement le sucre devenir jaune, puis s’étaler en prenant la couleur caramel,
puis une vapeur blanche s’échappe de la masse brune qui se forme ; il y a
augmentation de volume et la substance devient noire. Elle peut déborder du
bécher et se solidifie (voir la photographie après les schémas indiquant les
étapes que nous venons de décrire) :
|
|
|
|
Schémas des différentes étapes |
Résultat d’une expérience |
L’acide sulfurique est un agent déshydratant très
puissant. Il retire les molécules d’eau du sucre.
Globalement on peut écrire
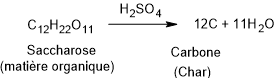
Mais l’acide sulfurique (H₂SO₄) ne fait pas flamber le
sucre au sens classique ; il l’assèche (enlève l’eau) en le
transformant en carbone pur.
Cette réaction est très exothermique, il y a
libération de chaleur ce qui provoque une augmentation brutale de la
température ; l’eau produite est vaporisée et fait gonfler le
carbone ; on obtient une masse noire spongieuse et fumante.
Le carbone formé piège la vapeur d'eau et les gaz
acides dégagés (SO₂, etc.), formant une colonne noire
mousseuse qui sort du récipient.
On désigne cette masse noire par le mot anglais
« char » qui dérive de « charcoal », un charbon obtenu par pyrolyse
(chauffage en l’absence d’air) du bois.
Ce char ainsi formé, une fois dégazé par la chaleur,
est très difficilement inflammable ; même chauffé très longtemps et très
fort il devient incandescent sans produire de flamme.
Remarques :
-1- L’acide sulfurique n’est pas le seul à agir ainsi
sur la matière organique ; on peut citer aussi l’acide phosphorique (H3PO4),
mais l’action est moins violente.
-2- L’action déshydratante de l’acide se manifeste non
seulement sur le saccharose mais sur l’ensemble des substances organiques et en
particulier la cellulose, qui est un constituant pratiquement universel des
végétaux.
2) Principe d’un retardateur de
flamme
Lors d’un feu de forêt, une des méthodes utilisées
pour essayer de contenir l’incendie est de larguer grâce à des avions ou des
hélicoptères bombardiers d’eau, un retardateur de flamme, au-delà du front des
flammes.
Ce retardateur agit sur les arbres et les végétaux et
il se forme, au moins en surface, comme dans l’expérience décrite avec le
sucre, un char qui, ne donnant pas de flamme, va stopper la propagation de
l’incendie. Il est crucial que la zone traitée soit suffisamment large, afin
que le vent ne puisse pousser les flammes au-delà de cette barrière
protectrice.
3) Un
exemple de retardateur de flamme
Il est largement utilisé dans la lutte contre les
incendies de forêt, notamment par les bombardiers d'eau.
Principaux composants :
Ø Phosphate mono-ammonium (NH4)H2PO4
et phosphate di-ammonium (NH4)2HPO4
Lorsqu'ils
sont exposés à la chaleur ils se décomposent en acide phosphorique qui favorise
la formation d'une couche de charbon (char) sur la végétation, réduisant ainsi
la combustibilité et ralentissant la propagation du feu.
Ø Sulfate d'ammonium
Il
complète l’action des phosphates en abaissant le point d’inflammation des
matériaux végétaux et en contribuant à la formation de la couche de char
protectrice ; en effet le sulfate d’ammonium se décompose à haute
température, libérant des produits comme NH₃, H₂SO₄ ou des espèces apparentées.
Ces
produits agissent de plusieurs façons :
NH₃ : gaz difficilement inflammable qui dilue
les gaz combustibles et ralentit la combustio
H₂SO₄ : puissant agent déshydratant,
qui retire l’eau des fibres végétales (cellulose, lignine) avant
qu’elles ne puissent brûler efficacement.
Résultat
: les matériaux végétaux commencent à se carboniser à plus basse
température, sans flamme vive, ce qui donne une transition vers
le char plutôt que la combustion complète.
C’est
une argile naturelle fibreuse, un silicate hydraté de magnésium et d’aluminium
de formule générale (Mg,Al)2Si4O10(OH).4H2O
Elle
agit comme épaississant et agent de suspension, assurant une distribution
uniforme du produit et une meilleure adhérence aux surfaces végétales.
C’est aussi un agent
épaississant ; il augmente la viscosité du mélange pour améliorer
l’adhérence du retardateur sur la végétation et réduire le ruissellement.
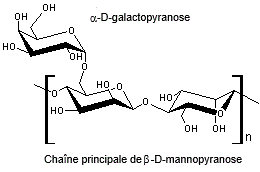
La gomme de guar est composée
principalement de galactomannane, une fibre végétale
soluble et acalorique. Le galactomannane est un
polymère linéaire composé d’une chaîne de monomères de mannose (β-D-mannopyranose) à laquelle sont ramifiés, par un pont 1-6,
des unités de α-D-galactopyranose.
|
|
|
Motif du polymère gomme de guar |
Le ratio entre le mannose et le
galactose est de 2 pour 1, ainsi en moyenne une unité de galactose est ramifiée
tous les deux mannoses sur la chaîne. Par comparaison, il est de 4 pour 1 pour
la gomme de caroube et 3 pour 1 pour la gomme tara.
Ø
Colorants
En général rouge
vif ; ils permettent de visualiser les zones traitées depuis les airs, ce
qui évite le chevauchement et optimise le traitement.