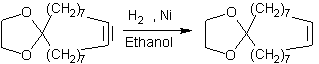LES SYNTHESES 2
Plan
de l'étude
: Plan général des synthèses
·
Addition des composés organo-métalliques : à l'éthylorthoformiate au
diméthylformamide
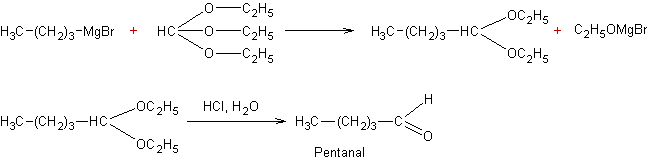
v Au diméthylformamide
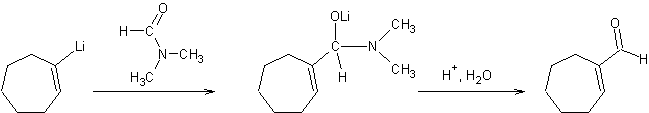
·
Déshydrogénation des alcools
par le cuivre :
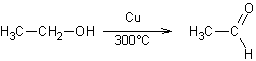
·
Formylation des arènes par le monoxyde de carbone : Gattermann-Koch Gattermann Riemer-Tiemann
v Formylation de Gattermann-Koch :
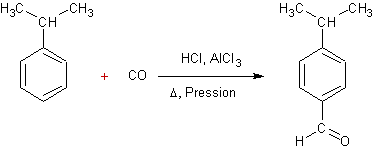
On
peut opérer à la pression ordinaire à condition d'ajouter du chlorure de
cuivre(II)
v Formylation de Gattermann :
Elle
est réservée aux phénols et aux éthers phénoliques.
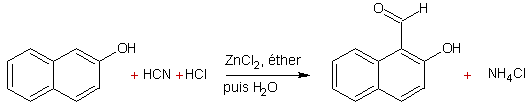
v Formylation par
Riemer-Tiemann :
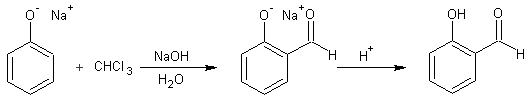
·
Hydratation de certains alcynes :
v

v
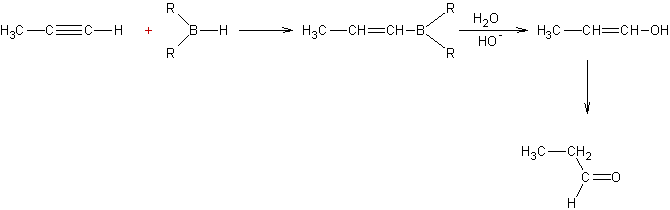
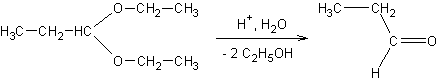
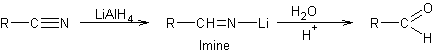
·
Oxydation des alcools primaires : Méthode d'Oppenauer Par l'acide chromique Par
le complexe CrO3-pyridine Biochimique
v Méthode d'Oppenauer
:
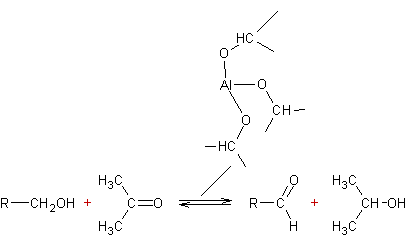
v Par l'acide chromique
H2CrO4 (Cr2O72-
ou CrO3 en milieu sulfurique) en milieu acétique :
(R-CH2OH ![]() R-CHO + 2H+ + 2e-) x3
R-CHO + 2H+ + 2e-) x3
![]()
Le
bilan :
Cr2O72-
+ 3 R-CH2OH + 8H+![]() 3 R-CHO + 2Cr3+ + 4H2O
3 R-CHO + 2Cr3+ + 4H2O
v Par le complexe
trioxyde de chrome-pyridine :
Dans
certains cas où le milieu acide fort est gênant, on peut utiliser le complexe
trioxyde de chrome-pyridine, la pyridine servant aussi de solvant :
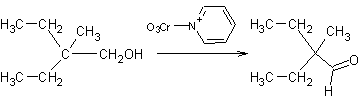
L'alcool
déshydrogénase (ADH) en conjonction avec NAD+ (le nucléotide adénine-nicotinamide)
qui joue le rôle d'accepteur d'hydrogène :
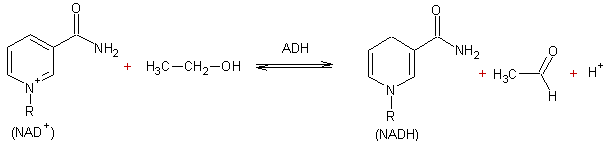
Cette
réaction est stéréospécifique :
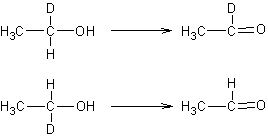
·
Oxydation des alcènes : par l'intermédiaire des 1,2-diols par
l'ozone
v par l'intermédiaire
des 1,2-diols :
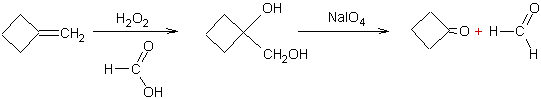
v Oxydation des alcènes
par l'ozone :

·
Oxydation des halogénures de type benzylique (réaction de Sommelet) :


·
Oxydation des p.toluènesulfonates (tosylates) :
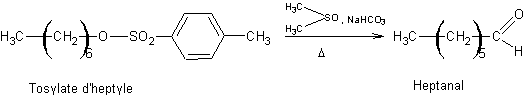
·
Oxydation des vinylboranes :

·
Réarrangement des 1,2-diols (réarrangement pinacolique) :
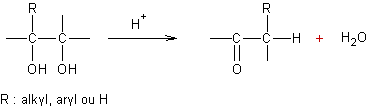
·
Réduction des chlorures d'acyle : Par les hydrures Par l'hydrogène
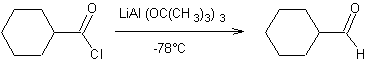
v Par l'hydrogène
(Rosenmund)
:
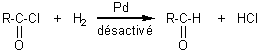
·
Réduction des amides tertiaires par les hydrures :
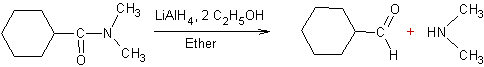
Le
réducteur est [LiAlH2(OC2H5)2] plus
doux que LiAlH4 ; il ne réduit pas l'aldéhyde en alcool.
·
Réduction des nitriles par les hydrures :
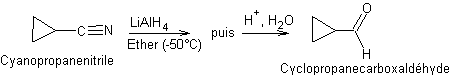
·
Réduction des alcynes par les borohydrures :
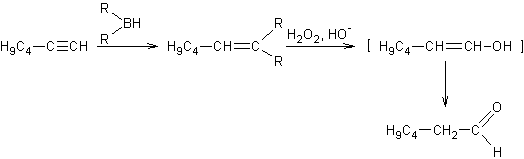
·
Réduction des acides par NADPH ( Nicotinamide-Adénine Dinucléotide
Phosphate)
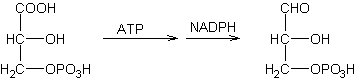
·
Déshydratation des alcools :
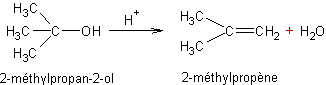
Cette
déshydratation est plus facile pour les alcools III que pour les alcools II ou
I.
·
Déshydrohalogénation des halogénures
d'alkyle
:
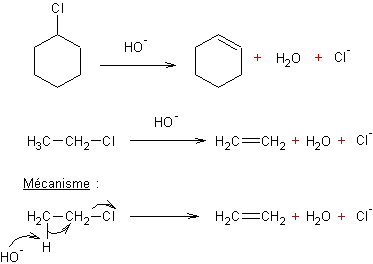
La
facilité de cette réaction dépend de la nature de l'halogène, de la classe du
carbone, de la nature de la base de la façon suivante :
- Halogène : I>Br>Cl>F
- Carbone : C(III)>C(II)>C(I)
- Base : NH2- >-O-C2H5>-OH
·
Dimérisation d'un alcène :
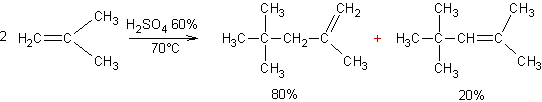
·
Isomérisation d'un alcène :
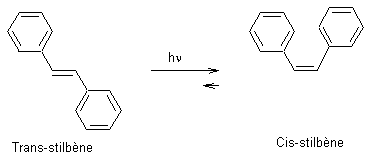
·
Elimination à partir des éthers :

·
Condensation des cétones avec des alkylidènephosphoranes :
Remarque
:
Alkylidènephosphorane :
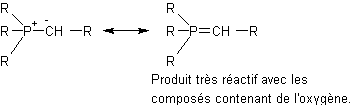
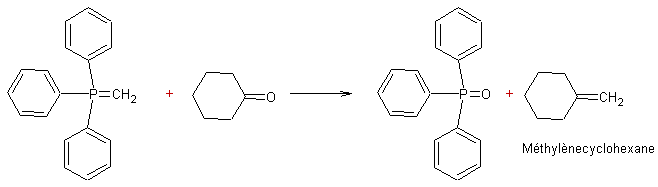
Exemple
2 :

·
Déshalogénation des 1,2-dihalogénures par les iodures
![DESHALOGENATION].gif](LESSYNTHESES2_fichiers/image074.gif)
|
|
||
|
|
Des hydrogénosulfates d'alkyle :
![]()
Des hydroxydes d'alkylammonium (Elimination d'hoffmann) :



Des méthylxanthates
:
Cette réaction est une partie de la réaction dite "Elimination de
Chugaev" :
Il s’agit de la préparation d’un
alcène à partir d’un alcool. L’alcool, après avoir été transformé en
méthylxanthate, en milieu basique, par action sur du disulfure de carbone puis
de l’iodure de méthyle, est pyrolysé à 200°C.

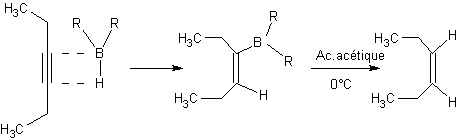
Par les hydrures de bore :
En présence d'acide acétique, dans des
conditions opératoires douces, les hydrures de bore réagissent sur les alcynes
pour donner des alcènes. Avec les acétylènes disubstitués le processus est
pratiquement stéréospécifique conduisant à des alcènes cis.
Par hydrogénation catalytique :