LES SYNTHESES (3)
Plan
de l'étude
: Plan général des synthèses
Alcanes Epoxydes (ou oxiranes) Halogénoalcanes
·
Réduction des alcènes par
les hydrures de bore :
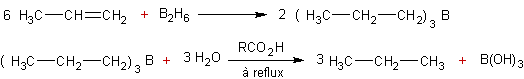
·
Réduction catalytique des
alcènes par le dihydrogène :
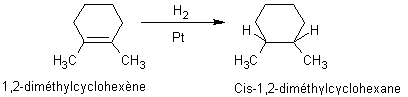
·
Réduction du cyclopropane et
du cyclobutane par hydrogénation catalytique
:
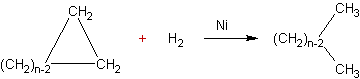
·
Alkylation des alcènes :
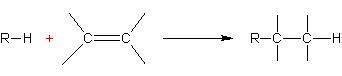
Exemple
:
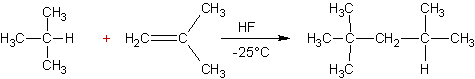
Mécanisme :
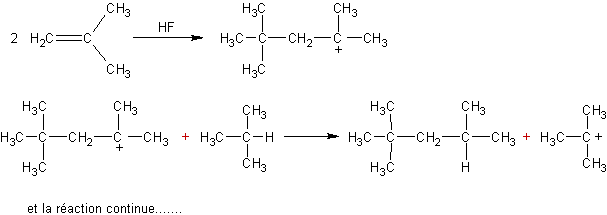
·
Décarboxylation des acides
carboxyliques :
v On
chauffe le sel de sodium de l'acide carboxylique en présence d'hydroxyde de
sodium et d'hydroxyde de calcium :
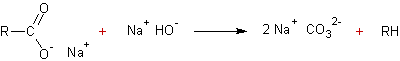
v Electrolyse
de Kolbe
: Il s'agit de l'électrolyse d'un carboxylate de sodium ou de potassium :
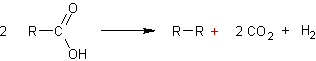
Le
détail est :
- à l'anode :
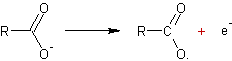
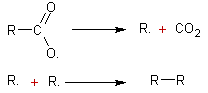
- à la cathode :
![]()
·
A partir des organolithiens
et des halogénures de cobalt :
v Organolithiens
:
![]()
v Halogénure
de cobalt :
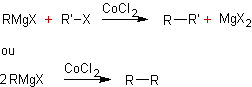
·
Réduction des cétones par l'hydrazine : (Réaction de Wolff-Kishner modifiée par
Huang-Minlon)
Cette
réaction n'est utilisée que quand les groupements R- de la cétone sont stables
en milieu basique et instables en milieu acide. Dans le cas contraire on
utilise la méthode de Clemmensen.
![]()
Mécanisme :

·
Réduction des cétones par le zinc
(Méthode
de Clemmensen)
Surtout
utilisé quand le R- de la cétone est sensible (instable) aux acides.
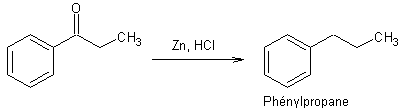
·
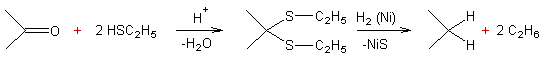
Utilisation des thioacétals :
Méthode
utilisée quand le R- de la cétone est sensible aux acides et aux bases.
EPOXYDES
(ou
oxiranes)
|
|
·
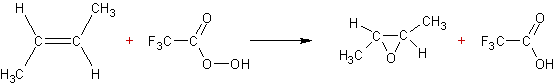
A partir des alcènes : par action d'un acide percarboxylique (ou peracide
carboxylique).
·
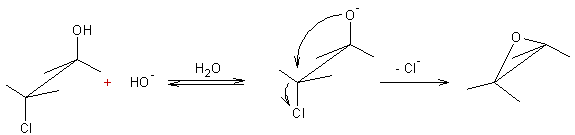
A partir des α-halohydrines : Par action d'une base (Elimination SN2
interne).
HALOGENOALCANES
(et
halogénures d'alkylaryle)
·
Addition radicalaire d'halogénures
d'hydrogène à des alcènes :
![]()
C'est
une addition anti-Markownikov : c'est l'effet Kharasch)
·
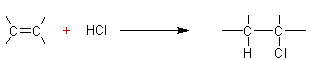
Addition ionique d'halogénures
d'hydrogène à des alcènes :
Cette
addition obéit à la règle de Markownikov.
Exemple
1 :
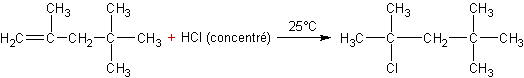
Exemple
2 :
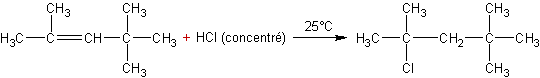
·
Réaction de Meerwein
(Alcènes
+ halogénures d'aryldiazonium) :
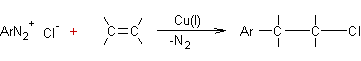
·
Chloration des alcanes du benzène ou des
arènes avec le dichlore :
v Alcanes :
Réactions de substitution avec les halogènes:
réactions radicalaires, photochimiques en chaînes, conduisant à des mélanges de
dérivés halogénés.
ex: en
présence de lumière (U.V)
Exemple 1 : Chloration du méthane
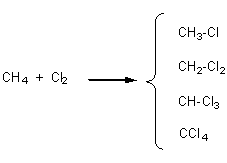
CH4+
Cl2![]() mélange de
mélange de
CH3Cl
: monochlorométhane
CH2Cl2
: dichlorométhane
CHCl3
: trichlorométhane (ou chloroforme)
CCl4:
tétrachlorométhane (ou tétrachlorure de carbone)
Remarque:
Il
s'agit d'une réaction en chaîne comportant 3 étapes:
Initiation :
Sous
l'action d'UV une molécule de dichlore se scinde en deux atomes (rupture
homolytique):
![]()
Propagation:
Les deux
réactions ci-dessous se produisent des centaines de fois:
![]()
Arrêt:
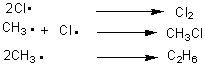
Le
dérivé monochloré peut à son tour participer à une deuxième réaction de
chloration...
Exemple 2 :
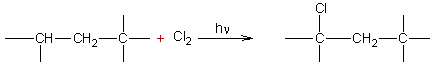
v Benzène :

Cette
réaction a lieu sous l'action des ultra-violets, à la température ordinaire ou
avec un chauffage léger (50°C) ; le benzène se sature en une seule fois, on
obtient le 1,2,3,4,5,6-hexachlorocyclohexane (anciennement utilisé comme
insecticide sous l'appellation commerciale HCH).
v Toluène :
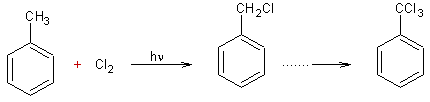
·
Chloration des alcanes du benzène ou
des arènes avec le chlorure de sulfuryle :
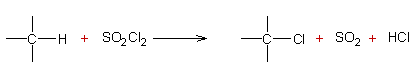
Réaction radicalaire :
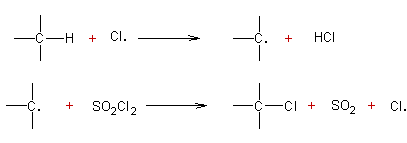
Exemple 1 :
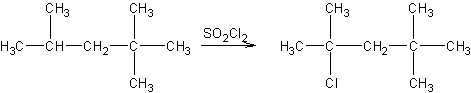
Exemple 2 :
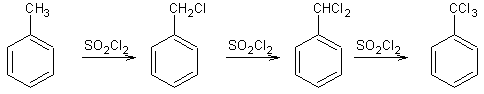
·
Chloration
par l'hypochlorite de tertiobutyle :
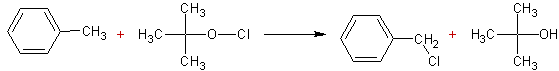
Mécanisme :

·
Bromation
par le N-bromosuccinimide :
C'est la
réaction de Wohl-Ziegler
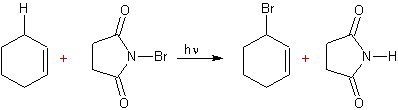
Mécanisme :

- A
partir des alcools par réaction avec les halogénures de
phosphore
:
![]()
Réaction
surtout utilisée pour les alcools primaires. La pyridine maintient l'acidité à
un faible niveau.
·
A
partir des alcools par réaction avec le
chlorure de thionyle :
![]()
Exemple :

Il y a
inversion de la configuration.
·
A
partir d'un halogénoalcane par réaction
avec un ion halogénure :
![]()
Exemple :
![]()
![]()
·
A partir d'un éther oxyde par action d'un halogénure d'hydrogène :
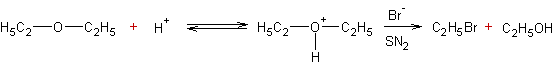
·
Action du bromure de nitrosyle sur les amines primaires :
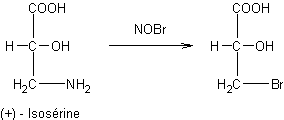
·
Chlorométhylation des composés arylés ou apparentés :

·
Décarboxylation des carboxylates d'argent (Réaction d'Hunsdiecker) :
C'est une réaction radicalaire :
![]()
·
Déplacement
des alcools par les halogénures d'hydrogène :
![]()
La
réactivité des alcools (III) est supérieure à celle des alcools (II) elle-même
supérieure à celle des alcools (I).
Les
chlorures nécessitent ZnCl2 comme catalyseur :
![]()