LES SYNTHESES 4
Plan
de l'étude
: Plan général des synthèses
- Addition aux
alcènes des
hydrures de bore
(Hydroboration) :
1er
exemple
:
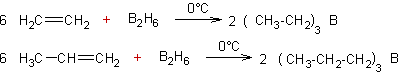
2ème
exemple
:

![]()
![]()
- Réaction des halogénures de phosphonium
avec le phényllithium : (Réaction de Wittig)
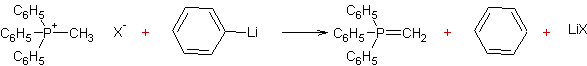
Pour
donner l'alkylidènephosphorane :
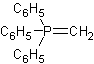
(méthylènetriphénylphosphorane).
v Des dihalogénoalcanes :
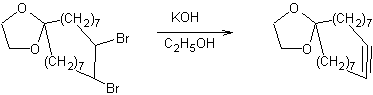
v Des halogénures de vinyle :

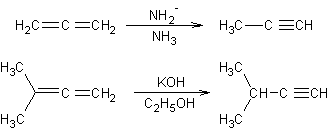
- A partir des
halogénures d'alkyle (déplacement par les acétylures) :
![]()
- Couplage des 1-Alcynes :
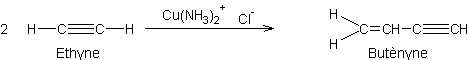
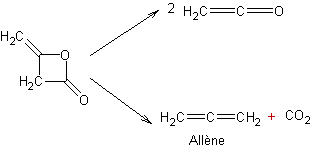
- Pyrolyse des dicétènes :
Le
dicétène ou vinylacéto-β- lactone peut être pyrolysé ; il donne le cétène (un
allène) et du dioxyde de carbone :
|
|
|
Détail :


Les
proportions relatives des deux produits dépendent étroitement des conditions
opératoires (température, solvant, durée de la réaction).
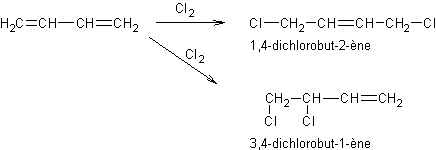
- Halogénation des alcènes
v Par le N-bromosuccinimide :
C'est
une réaction radicalaire initiée par la lumière ou les peroxydes….

![]()
Cette
réaction a constitué la préparation du chlorure d'allyle.
Oxydation
des amines tertiaires par le peroxyde d'hydrogène :
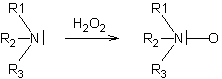
Rappel :quand elles sont
fortement chauffées, ces oxydes d'amines se décomposent en donnant des alcènes
:
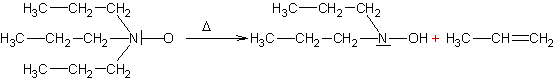
|
|
|
C'est
la réaction de Ritter

C'est
la réaction de Bucherer :
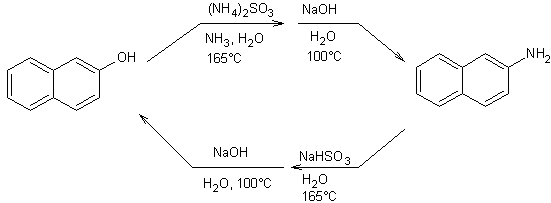
C'est
la réaction de Chichibabin :
C'est
une substitution nucléophile sur le cycle pyridinique par suite d'un traitement
par l'amidure de sodium dans l'ammoniac liquide.
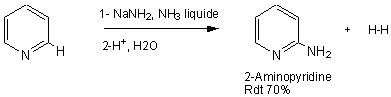
- Déplacement des
alcools par
les amines ou l'ammoniac:
![]()
Puis
la réaction continue et on obtient un mélange d'amines.
![]()
ou
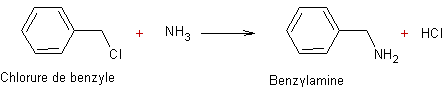
- Déplacement des
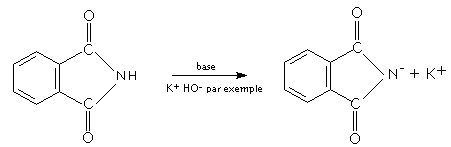
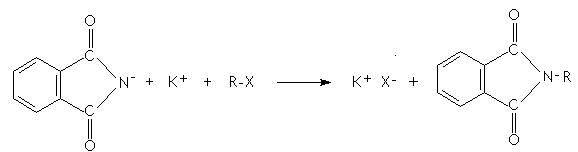
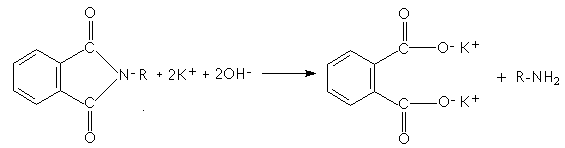
halogénoalcanes par le phtalimide :
C'est
la réaction de Gabriel : il s'agit d'un déplacement de type SN2 entre un anion
imide et un halogénoalcane I ou II.
Exemple
1 :
Cette
dernière étape (hydrolyse en milieu basique) peut être remplacée par une
hydrazinolyse (action de l'hydrazine) :
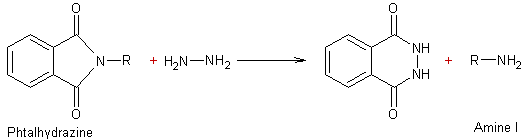
L'hydrazinolyse
est plus douce que l'hydrolyse en milieu basique.
Remarque :
La
molécule clé de cette synthèse est le phtalimide (amide secondaire de l'acide
orthophtalique) obtenu par action de l'ammoniac sur l'anhydride orthophtalique
:
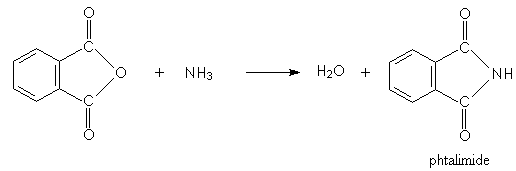
elle
permet de bloquer deux des trois hydrogènes de l'ammoniac.
Exemple
2 :

Exemple
1 :
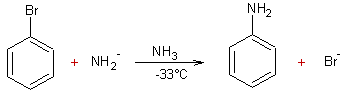
Exemple
2 :
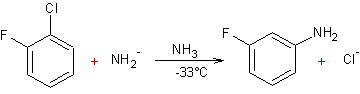
Le
mécanisme de cette réaction est tel que la substitution d'un atome de chlore
par le groupement amine se produit majoritairement sur le carbone en méta de
l'atome de fluor.
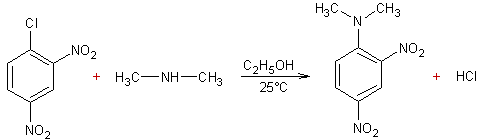
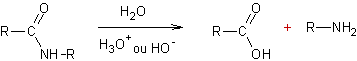
Réaction
lente
Exemple :
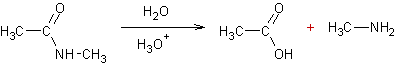
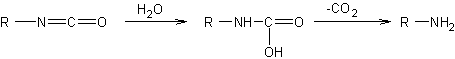
ou
![]()
- A partir des
nitriles et des alcools tertiaires
(Réaction de Ritter)
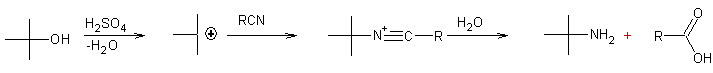
L'alcool
tertiaire donne un ion carbonium qui en se liant au nitrile et après hydrolyse
donne un amide qui est lui-même hydrolysé en amine.
- Réarrangement
des azotures d'acyle (obtenus par
dégradation de Schmidt ou réarrangement de Curtius)
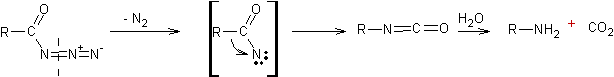
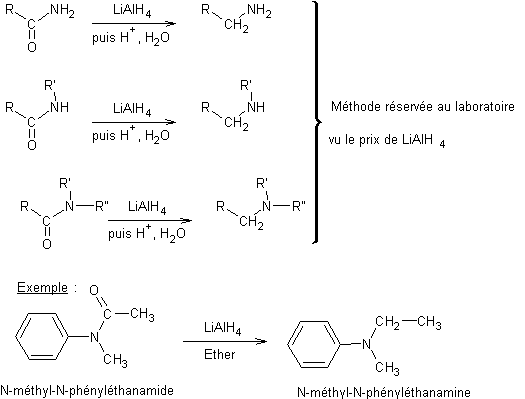
On
peut préparer des amines primaires en traitant des amides non substitués par un
hypobromite ou un hypochlorite :
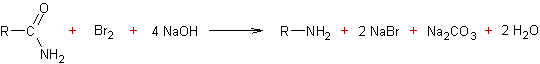
ou
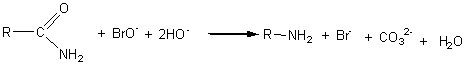
Mécanisme :

Exemple
1 :
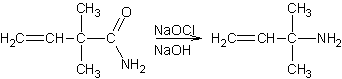
Exemple
2 :
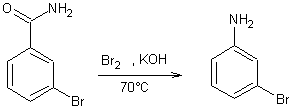
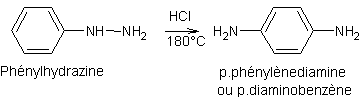
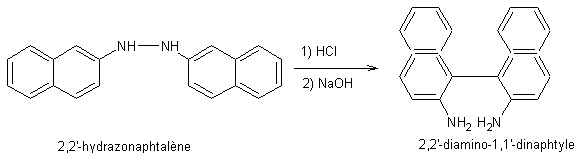
- Réarrangement des hydrazobenzènes
:
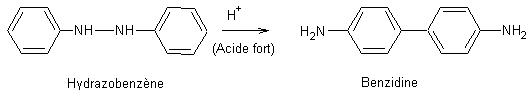
ou
- Réarrangement
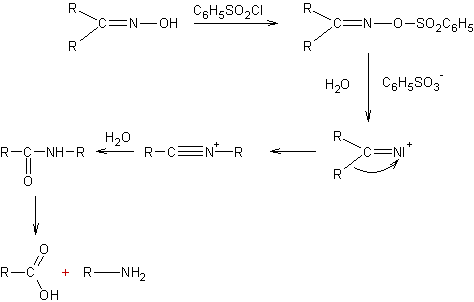
des oximes (Beckmann) :

ou
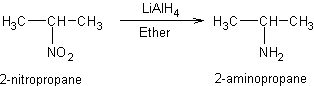
- Réduction des
composés azo,
azoxy, hydrazo par les métaux :
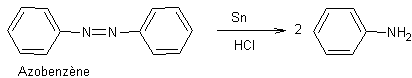
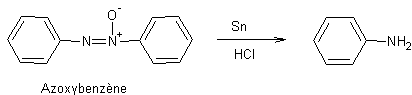
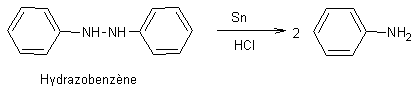
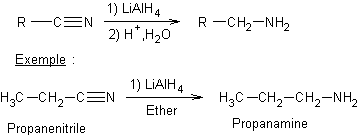
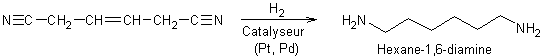
Exemple
1 :
![]()
Exemple
2 :
Exemple
3 :
Exemple
1 :
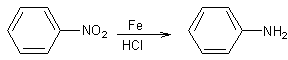
Exemple
2 :
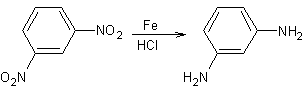
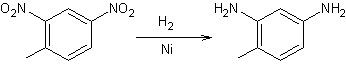
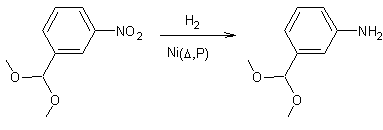
Les
sulfures d'ammonium ou de sodium peuvent réduire les composés nitrés :
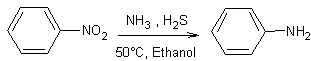
Si
le composé nitré possède deux fonctions nitrées, l'une des deux fonctions est
réduite plus rapidement que l'autre :
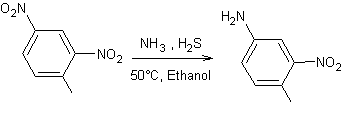
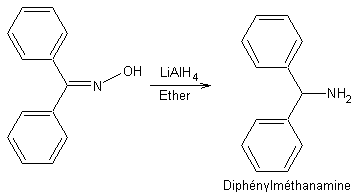
- Addition d'ammoniac et de cyanure
d'hydrogène aux aldéhydes : (réaction de Strecker)

- A partir d'un
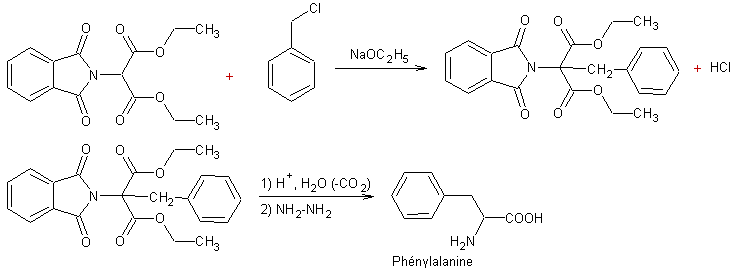
halogénoalkyle par action d'un ester phtalimidomalonique :
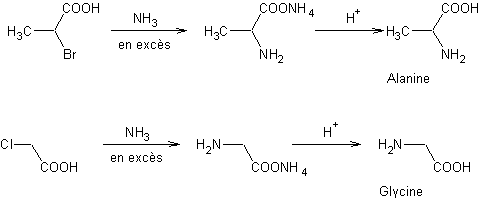
- Action de l'ammoniaque sur un acide
α-halogéné
:
- Hydrolyse des
peptides et
des protéines
:
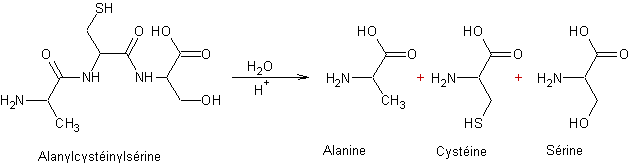
|
|
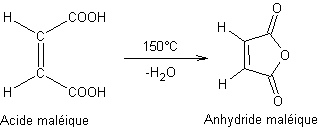
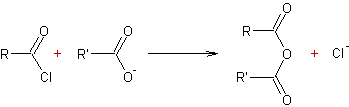
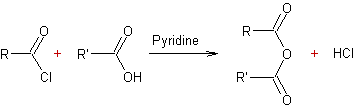
- Déplacement des halogénures
d'acyles par les ions carboxylates ou les acides carboxyliques :

- 1,4-cycloaddition de l'anhydride maléique aux polyènes :
Ø 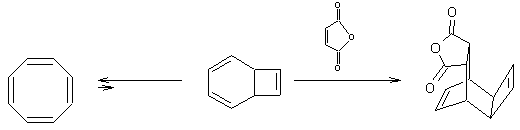
Ø 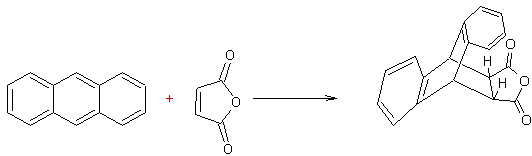
Ø 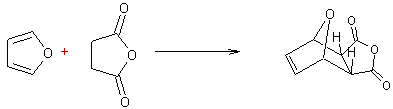
- Oxydation des arènes :
Ø 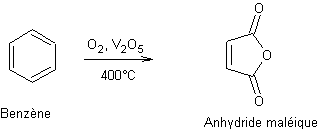
Ø 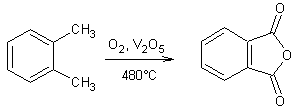
Ø 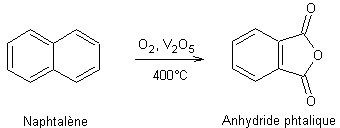
|
|
|
Ø 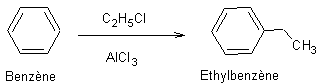
Ø 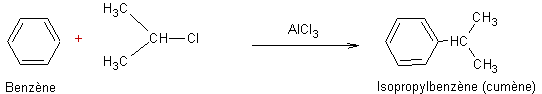
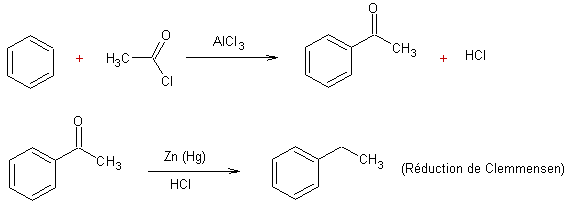
- Acylation des arènes puis
réduction
:
- Reformage catalytique des
alcanes
:
On
fait passer un mélange d'hydrocarbures (pétrole) et d'hydrogène en excès sur un
catalyseur (Alumine ou platine) à 900°C et 200 à 500 atm.
Différentes
transformations ont lieu et en particulier :
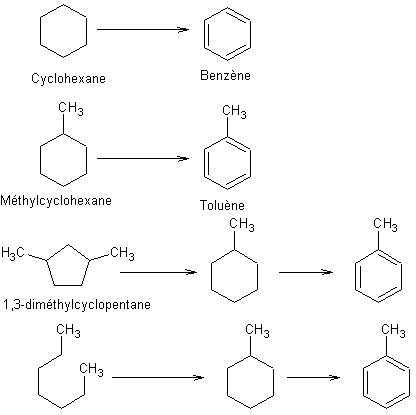

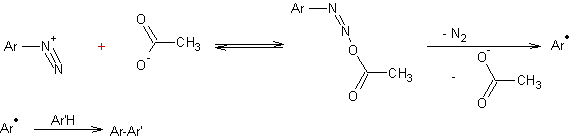
- Décomposition des diazoacétates
:
- Désulfonation des acides
arylsulfoniques par la vapeur d'eau :
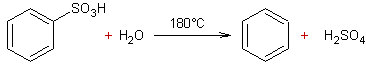
- Hydrodésalkylation des arènes :

![]()
Cette
réaction a un mécanisme radicalaire :
