LES SYNTHESES 7
Plan de l'étude : Plan
général des synthèses
|
|
ACIDES DICARBOXYLIQUES ET DERIVES
|
|
|
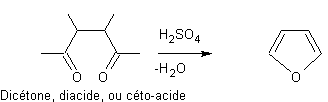
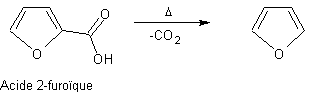
Exemple :
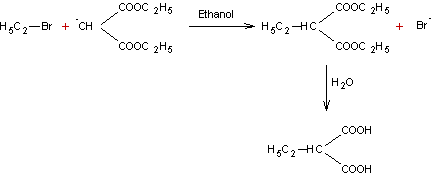
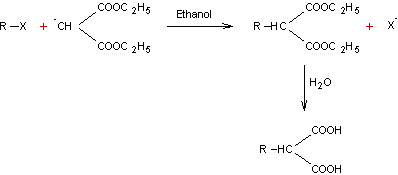
- Hydrolyse des acides cyanocarboxyliques
Exemple
1 :
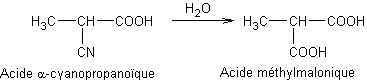
Exemple
2 :
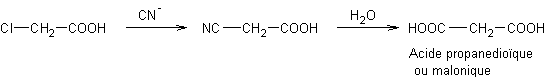
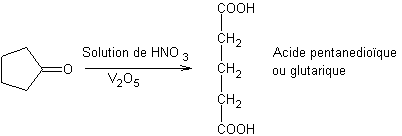
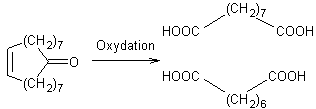
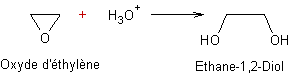
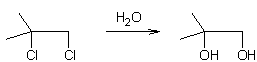
Exemple 1 :
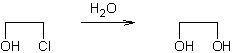
Exemple 2 :
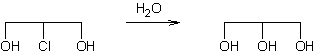
On aboutit au glycérol.
Ø Par le tétroxyde d'osmium :
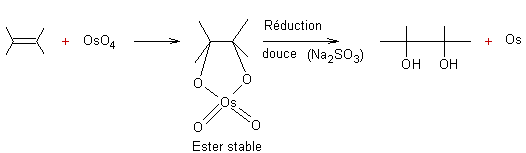
Exemple 1 :
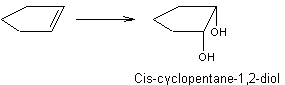
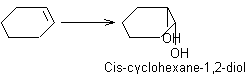
Exemple 2 :
Ø Par l'acide perméthanoïque (acide méthanoïque en présence de peroxyde d'hydrogène) :
Exemple 1 :
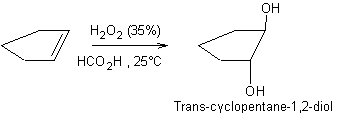
Exemple 2 :
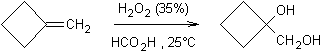
Ø Par le permanganate :
Exemple 1 :
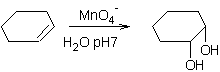
Exemple 2 :
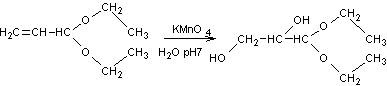
- Réduction des composés carbonylés par un amalgame de sodium :
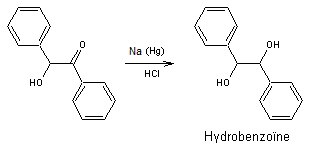
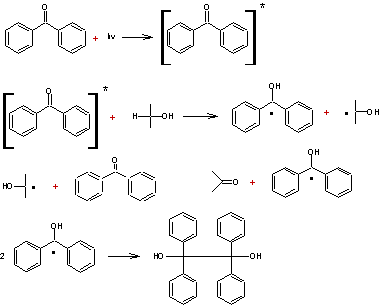
- Réduction photochimique de la benzophénone par l'isopropanol :
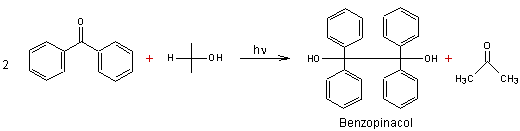
Mécanisme :
- 1,3-cycloaddition des alcènes :
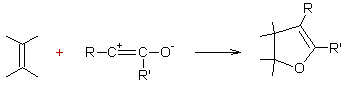
Remarque : le composé qui s'additionne est obtenu par action de la lumière sur une diazocétone :
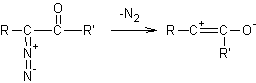
- 1,3-cycloaddition à des groupes carbonyles :
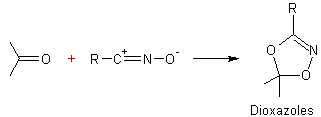
Le composé qui
s'additionne est un nitrile oxyde :
![]()
- Oxydation des thiols :
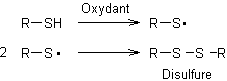
L'oxydant utilisé peut être O2, X2, H2SO4 …
Dans certains cas,
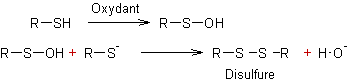
- Condensation d'une amine (II) avec aldéhydes ou cétones :
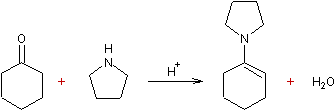
Les énamines préparées à
partir des aldéhydes sont moins stables.
|
|
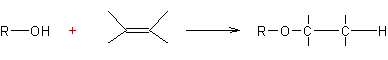
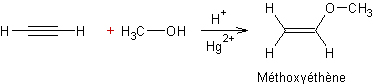
![]()
Exemple :
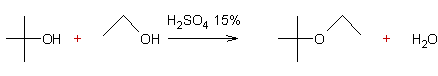
Avec catalyseurs :
![]()
![]()
![]()
Exemple 1 :
Exemple 2 :
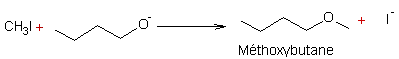
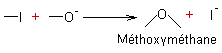
- Déplacement des halogénures d'alkyle par les ions énolates (O-alkylation) :

Exemple :

Exemple 1 :
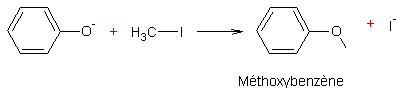
Exemple 2 :
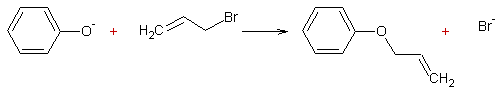
Exemple 1 :

Exemple 2 :
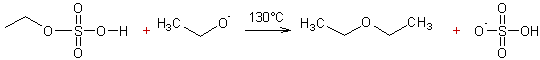
Exemple 3 :
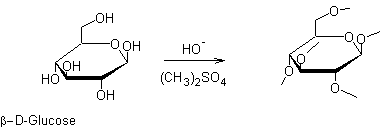
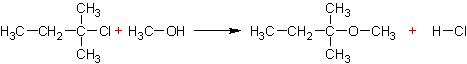
- Déplacement des sulfates d'alkyle par les phénols en milieu basique :
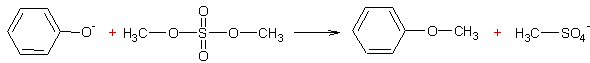
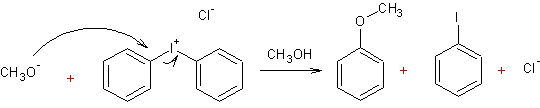
- Déplacement des sels d'aryliodonium par les ions alkoxydes :
![]()
Exemple :
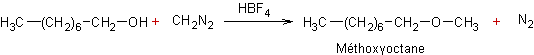
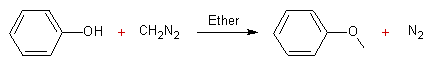
Exemple 1
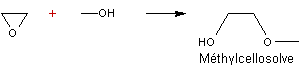
Exemple 2
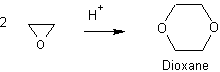
Exemple 3
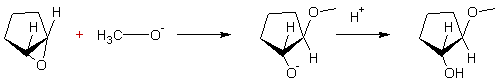
![]()
Exemple :
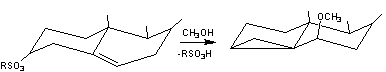
Structure partielle d'un ester sulfonate du cholestérol.
- Condensation des composés possédant un groupement carbonyle, α-chlorés avec les β-cétoesters :
En présence d'une base :
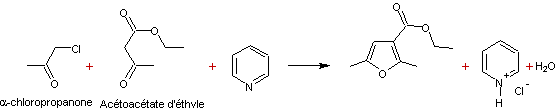
- Condensation des composés 1,4-dicarbonylés :