OESTROPROGESTATIFS
Gérard GOMEZ
1) Définition Généralités :
Les
oestroprogestatifs sont des médicaments alliant deux hormones ; ils sont soit à
visée contraceptive soit à visée thérapeutique dans le cas d'anomalies du
fonctionnement hormonal féminin. Nous n'examinerons ici que les médicaments
contraceptifs oraux couramment désignés par "pilules contraceptives"
ou plus simplement "pilules".
L'une
des deux hormones a un pouvoir strogène et régule le cycle menstruel. L'autre,
une hormone progestative, joue le rôle de contraceptif ; elle bloque
l'ovulation en inhibant deux hormones du cycle féminin la LH et la FSH (document 1) ; elle épaissit la glaire cervicale, cette
sécrétion de glycoprotéines au niveau du col de l'utérus, ce qui rend plus
difficile le passage des spermatozoïdes ; elle modifie l'endomètre (elle
amincit cette muqueuse qui tapisse l'intérieur de l'utérus) ce qui rend plus
difficile la fixation de l'uf fécondé.
C'est
en 1957 qu'est apparue la première combinaison oestroprogestative ; l'strogène
était le mestranol :
et
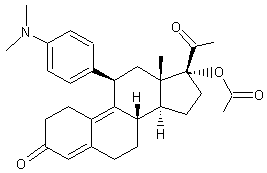
le progestatif, le Noréthynodrel :
Les caractéristiques de ces deux
molécules sont données dans les annexes (a) et (b).
Depuis, beaucoup d'autres
oestroprogestatifs ont été commercialisés ; nous allons tour à tour voir quels
sont les oestrogènes et les progestatifs utilisés.
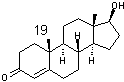
Remarque :
La présentation des
oestroprogestatifs suppose une bonne connaissance de la numérotation habituelle
du noyau des stéroïdes. Nous la rappelons :
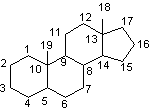
C'est
très souvent une hormone de synthèse de type stéroïde,
l'éthynyloestradiol :
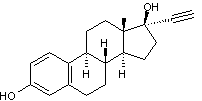
dont les caractéristiques sont
regroupées dans l'annexe 1.
Cette molécule dérive d'un des
principaux oestrogènes naturels, l'oestradiol :
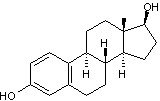
par remplacement d'un hydrogène du
carbone 17 par un groupement éthynyle.
Sa synthèse a été réalisée la
première fois en 1938.
On peut obtenir cette molécule en
une étape par éthynylation de l'oestrone par l'éthyne (acétylène) en présence
d'une base forte, l'amidure de sodium :
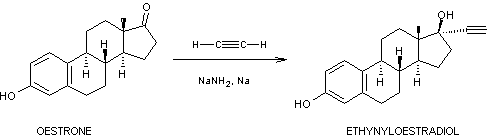
Des développements récents conduisent
à utiliser directement l'oestradiol comme strogène au lieu de son dérivé
éthynylé ; bien que ce soit un produit de synthèse, on emploie alors
l'expression très parlante de pilule à strogène "naturel" parce que
l'oestradiol est l'hormone présente dans l'organisme (document
1).
3) Les hormones progestatives
:
Contrairement à l'hormone strogène
qui, nous l'avons dit, est très souvent l'éthynyloestradiol, on utilise
plusieurs hormones progestatives.
Ce sont des hormones de synthèse
dont le rôle s'apparente à celui de l'hormone naturelle, la progestérone :
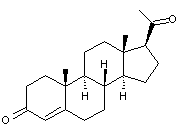
On trouve par exemple :
-
Noréthistérone dont la formule est :
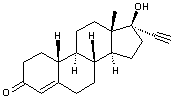
Cette molécule de synthèse a une
structure voisine de la 19-nortestostérone (annexe (c)).
Elle en dérive par remplacement d'un hydrogène du carbone 17 par un groupement éthynyle. Elle est présente dans
des oestroprogestatifs de première génération.
Les caractéristiques de cette
molécule sont données dans l'annexe 2.
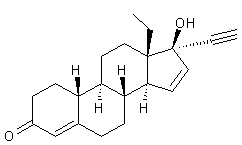
-
Norplant ou Norgestrel (-) ou lévonorgestrel dont la formule est
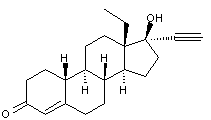
Cette molécule de synthèse a une
structure voisine de la 19-nortestostérone (annexe (c)).
Elle est présente dans des oestroprogestatifs de deuxième génération.
Les caractéristiques de cette
molécule sont données dans l'annexe 3.
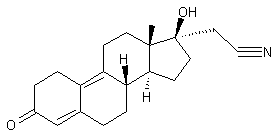
-
Gestodène
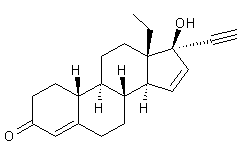
Cette hormone de synthèse a une
structure voisine de la 19-nortestostérone (annexe (c)).
Elle possède une très faible activité androgénique. Elle est présente dans des
oestroprogestatifs de troisième génération.
Ses caractéristiques sont données
dans l'annexe 4.
-
Diénogest
De structure voisine de la
19-nortestostérone (annexe (c)) cette molécule de
synthèse ne possède pas de groupement éthynyle. Elle possède une très faible
activité androgénique. Elle est présente dans des oestroprogestatifs de
quatrième génération.
Ses caractéristiques sont données
dans l'annexe 5.
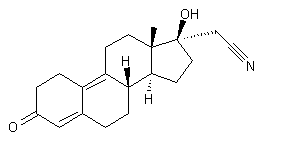
Une spironolactone de synthèse
présente dans des oetroprogestatifs dits de quatrième génération ; son profil
est similaire à celui de la progestérone.
Ses caractéristiques sont données à l'annexe 6.
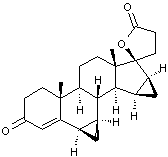
-
Norgestimate :
C'est un progestatif de synthèse
présent dans les contraceptifs oraux dits de troisième génération. Il ne
présente pratiquement pas d'effet androgène.
Ses caractéristiques sont données à l'annexe 7.
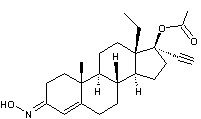
-
Désogestrel :
C'est un progestatif de synthèse
présent dans les contraceptifs oraux dits de troisième génération. Il ne
présente pratiquement pas d'effet androgène.
Ses caractéristiques sont données à l'annexe 8
 .
.
4) Les différentes générations
d'oestroprogestatifs :
C'est par la nature du progestatif
que l'on distingue les différentes générations de contraceptifs oraux.
La première génération est apparue
dans les années 1960 et la deuxième entre 1970 et 1980.
C'est pour pallier certains
inconvénients comme par exemple les effets androgènes des progestatifs utilisés
dans ces médicaments que des oestroprogestatifs de troisième et quatrième
génération ont été mis au point dans les années 1990-2000.
Il est apparu que ces derniers
augmentaient les risques de thrombose veineuse et d'accidents vasculaires cérébraux
ischémiques par rapport aux médicaments de deuxième génération ; dès lors ils
ont été réservés à des profils particuliers de femmes ne supportant pas les
oestroprogestatifs de deuxième génération.
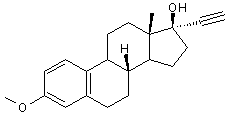
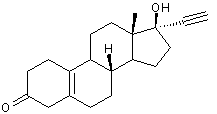
5) Retour sur le Norplant ou
Lévonorgestrel :
Ce progestatif, on l'a dit, entre
dans la composition des contraceptifs oraux de deuxième génération, à faible
dose. Il sert également à forte dose, de "contraceptif" d'urgence
(pilule dite du lendemain) ; on ne parle plus alors de contraception mais de
contragestion.
Il est pour ce dernier usage, en
concurrence avec une autre molécule de synthèse, l'acétate d'ulipristal, un
inhibiteur des récepteurs de la progestérone, commercialisé en Europe sous le
nom d'Ellaone :
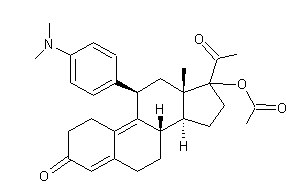
ainsi qu'avec la mifépristone ou
RU-486 une autre molécule de synthèse plus ancienne, inhibitrice elle aussi des
récepteurs de la progestérone :
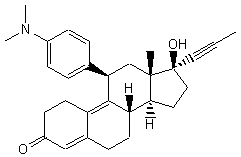
On trouvera en annexe
9 les caractéristiques de l'acétate d'ulipristal et en annexe
10 les caractéristiques de la mifépristone.
6) Oestroprogestatifs et
environnement :
Depuis novembre 2012, la
directive-cadre sur l'eau du Parlement européen, directive visant à prévenir et
réduire la pollution des eaux, impose que l'éthynyloestradiol et l'oestradiol
soient surveillés et contrôlés dans les eaux de surface en Europe en attendant
d'établir des normes quand les données sur ces molécules seront suffisamment
nombreuses.
On relève sur la thèse de Olivier
Bazard (du premier avril 2011) intitulée "Les médicaments dans les eaux :
Présence et impact écotoxicologique
"
(http://www.scd.uhp-nancy.fr/docnum/SCDPHA_T_2011_BAZARD_OLIVIER.pdf)
les points suivants :
L'éthynyloestradiol a un temps de
demi-vie qui se situe entre 46 et 81 jours dans les eaux de surface, 4,5 et 120
jours dans les sols et 240 à 540 jours dans les sédiments.
L'éthynyloestradiol est excrété dans
les urines sous forme de glucuronide ; certaines bactéries sont capables de le
libérer de ce composé ; il se fixe alors sur des particules en suspension et
peut être transporté sur de longues distances.
Les effets de l'éthynyloestradiol
sur les poissons sont la féminisation et des effets nuisibles sur la
reproduction.
Ces effets ne se font pas sentir si
la concentration est inférieure ou égale à 0,05ng.L-1 ; dans la
plupart des eaux de surface ce seuil est largement dépassé (En moyenne, 4,3
ng.L-1 aux Pays-Bas ; 1,3 ng.L-1 en Corée).
A titre de simple information la
concentration, en Allemagne, de l'éthynyloestradiol dans l'eau potable est de
2,4 ng.L-1.
Document 1 : Cycle
menstruel et hormones.
La fonction de reproduction chez la
femme met en jeu l'ovaire et l'utérus mais aussi l'hypothalamus et l'hypophyse.
L'hypothalamus sécrète une
gonadostimuline la GnRH (acronyme de Gonadotropin-Releasing Hormone) une
hormone peptidique qui stimule la synthèse et la libération de gonadotrophines
par l'hypophyse : l'hormone lutéinisante (LH) et l'hormone folliculo-stimulante
(FSH) qui sont deux hormones glycoprotéiques.
La LH intervient essentiellement
pour provoquer l'ovulation.
La FSH active la croissance du
follicule ; Le follicule est un ensemble de cellules situées dans
l'ovaire, entourant l'ovocyte (la cellule qui évoluera en ovule après
maturation) et qui sécrètent les hormones sexuelles féminines : oestragènes et
progestérone. De ce fait, on voit que la FSH induit la sécrétion d'oestrogènes
(essentiellement l'oestradiol) jusqu'au 12ème jour du cycle. Ces
oestrogènes reconstituent et épaississent l'endomètre (paroi intérieure de
l'utérus).
A partir du 14ème jour et
jusqu'au 28ème, pendant la phase lutéale, le follicule se transforme
en corps jaune* qui sécrète oestrogènes et progestérone. Ces deux hormones
agissant en synergie stimulent notamment la formation de la dentelle utérine
pour la rendre prête à recevoir l'embryon si l'ovocyte est fécondé.
En l'absence de fécondation le corps
jaune régresse, il y a diminution de la concentration des hormones sexuelles et
il se produit la menstruation (évacuation de la muqueuse utérine).
Ce schéma des opérations est un
schéma très simplifié. En fait vient s'ajouter à ces actions un rétrocontrôle
de l'axe hypothalamus-hypophyse par l'ovaire.
La nature de ce rétrocontrôle
(positif c'est-à-dire renforçant l'action de l'hypothalamus et de l'hypophyse,
ou au contraire négatif, c'est-à-dire inhibant cette action) dépend du moment
considéré du cycle.
* Le corps jaune est ainsi appelé
parce quil contient de la lutéine, un pigment caroténoïde de formule
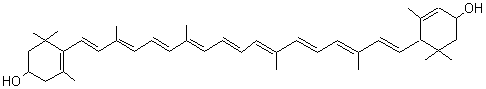
Absorption à λmax=
446 nm ; jaune à faible concentration, rouge orangé à plus forte concentration.
Annexe (a) : Caractéristiques du Mestranol
|
C21H26O2 Aspect : Cristaux Masse
molaire : 310,430
g.mol-1 Fusion : 151°C Solubilité : Soluble
dans le chloroforme, le dioxane, l'éther, l'éthanol ; insoluble dans l'eau. N°
CAS : 72-33-3 |
|
Annexe (b) : Caractéristiques du
Noréthynodrel
|
C20H26O2 Aspect : Cristaux (lorsque recristallisé
dans le méthanol) Masse molaire : 298,419 g.mol-1 Fusion : 170°C N° CAS : 68-23-5 |
|
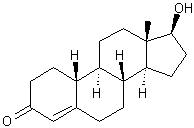
Annexe (c) : Caractéristiques de la 19-nortestostérone
|
19-Nortestostérone ou Nandrolone ou 17-hydroxyestr-4-èn-3-one C18H26O2 Aspect : Cristaux Masse molaire : 274,398 g.mol-1 Fusion : 112°C Solubilité : Soluble dans l'éthanol, l'éther,
le chloroforme. N° CAS : 434-22-0 |
19-nortestostérone C'est un stéroïde anabolisant. Remarque : Le préfixe 19- nor- signifie que
le groupement CH3 dont le carbone porte le numéro 19 dans la
numérotation habituelle des stéroïdes (voir testostérone ci-dessous), est
remplacé par un hydrogène.
|
Annexe 1 : Caractéristiques de
l'éthynyloestradiol
|
Ethynyloestradiol ou 19-Norpregna-1,3,5(10)-trien-20-yne-3,17-diol,
(17α)- C20H24O2 Masse molaire : 296,404 g.mol-1 Solubilité : Soluble dans le chloroforme ;
solubilité dans l'eau : 11,3 mg.L-1 à 27°C. N° CAS : 57-63-6 |
|
Annexe 2 : Caractéristiques de Noréthistérone
|
Noréthistérone ou Noréthindrone ou 19-Norpregn-4-èn-20-yn-3-one, 17-hydroxy-, (17α)- Aspect : Cristaux C20H26O2 Masse molaire : 298,419 g.mol-1 Fusion : 204°C N° CAS : 68-22-4 |
|
Annexe 3 : Caractéristiques de Norplant
|
Norplant ou Norgestrel(-) ou Lévonorgestrel Aspect : Cristaux lorsque recristallisé
dans le méthanol. C21H28O2 Masse molaire : 312,446 g.mol-1 Fusion : 206°C N° CAS : 797-63-7 |
|
Annexe 4 : Caractéristiques
du Gestodène
|
Gestodène C21H26O2 Masse molaire : 310,430 g.mol-1 N° CAS : 60282-87-3 |
|
Annexe 5 : Caractéristiques
du Diénogest
|
Diénogest C20H25 NO2 Masse molaire : 311,42 g.mol-1 Densité : 1,2 Ebullition : 549°C N° CAS : 65928-58-7 |
|
Annexe 6 : Caractéristiques
de la Drospirénone
|
Drospirénone C24H30O3 Aspect : Cristaux en poudre blanc cassé Masse molaire : 366,493 g.mol-1 Fusion : 198°C Ebullition : 552,2°C Densité : 1,26 N° CAS : 67392-87-4 |
|
Annexe 7 : Caractéristiques de Norgestimate
|
Norgestimate C22H31NO3 Masse
molaire : 369,497
g.mol-1 N° CAS : 35189-28-7 |
|
Annexe 8 : Caractéristiques du Désogestrel
|
Désogestrel C22H30O Aspect : Cristaux en poudre blanc cassé Masse molaire : 310,473 g.mol-1 Fusion : 109,5°C Ebullition : 428,3°C Solubilité : Pratiquement insoluble dans l'eau. N° CAS : 54024-22-5 |
|
Annexe 9 : Caractéristiques de l'acétate d'ulipristal
|
Ulipristal (acétate) ou CDB-2914 C30H37NO4 Masse molaire : 475,6191 g.mol-1 Fusion : 185°C Densité : 1,19 N° CAS : 126784-99-4 |
|
Annexe 10 : Caractéristiques de la mifépristone
|
Mifépristone |
|