CELLULES PHOTOVOLTAÏQUES
ORGANIQUES
Gérard GOMEZ
Plan de
l'étude
1) Généralités
2) Principe de fonctionnement des cellules photovoltaïques à
semi-conducteurs
3) Principe de fonctionnement des cellules photovoltaïques
organiques
4) Qualités des cellules photovoltaïques organiques et applications
5) Quelques polymères et quelques molécules utilisées dans la
technique OPV
5-2) Donneurs
d'électrons
1) Généralités :
Une
cellule photovoltaïque transforme l'énergie lumineuse qu'elle reçoit en une
tension électrique continue.
Deux
technologies existent, l'une assez ancienne, basée sur des semi-conducteurs
essentiellement à base de silicium (dite de première génération pour les
cellules rigides ou de deuxième génération pour les panneaux en couche mince et
éventuellement flexibles) et l'autre dite technologie souple ou flexible, plus
récente, basée sur les propriétés de certaines molécules organiques et désignée
par OPV (Organic PhotoVoltaics).
2) Principe de fonctionnement des cellules photovoltaïques à
semi-conducteurs :
Le
principe très sommaire de fonctionnement est le suivant :
On
superpose deux zones de silicium, l'une dopée n, l'autre dopée p et on crée
ainsi dans la zone frontière une diode.
Lorsqu'on
envoie un photon au travers de la zone dopée n un électron est arraché et il se
crée une paire électron-trou au niveau de la zone frontière ; celle-ci a été
créée pour éviter une recombinaison rapide des charges de signes opposés. Les
charges migrent sous l'effet des champs qui existent dans chacune des deux
zones, s'accumulent sur les faces opposées du système et créent ainsi une
tension continue.
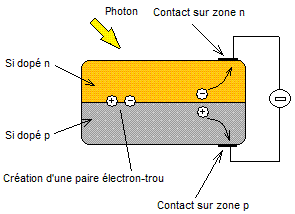
Le
rendement de ces cellules est de l'ordre de 15%.
3) Principe de fonctionnement des cellules photovoltaïques
organiques :
Elles
sont étudiées depuis les années 1970, mais avec un intérêt plus soutenu et un
essor plus rapide à partir des années 1990.
On associe
un polymère (par exemple le PCDTBT) et une molécule
(exemple le PC70BM) ; le premier joue le rôle de
donneur d'électrons et la seconde d'accepteur d'électrons, comme le montre le
schéma de principe simplifié ci-dessous :
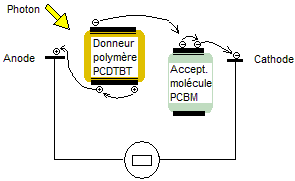
Le
rendement de ce type de cellules se situe entre 6% et 10%.
4) Qualités des cellules photovoltaïques organiques et applications
:
En
dépit d'un faible rendement, ces cellules possèdent quelques avantages par
rapport aux cellules à base de silicium :
¾
Elles correspondent à de faibles coûts
financiers et énergétiques.
¾
Elles ont un faible impact
environnemental.
¾
Elles peuvent s'intégrer facilement à
des structures souples ; on cite par exemple fréquemment la possibilité de les
intégrer à des toiles de tentes, structures placées généralement au soleil, qui
développent une grande surface et qui permettent de récupérer de l'énergie alors
que l'on est loin de toute autre source d'électricité.
On
procède par des techniques proches des techniques d'impression en incorporant
ces cellules dans des encres qu'on applique sur des supports plastiques.
On peut
les incorporer à des peintures que l'on sait enduire en couches très minces.
Les
vitres et les pare-brises de voitures constituent aussi des supports
intéressants.
5) Quelques polymères et quelques molécules utilisées dans la
technique OPV :
5-1) Accepteurs
d'électrons :
Certains
accepteurs d'électrons sont à base de fullerène 60 ou 70.
Compte-tenu
de leur structure les fullerènes sont de bons accepteurs d'électrons ; ils
permettent en effet une grande et facile délocalisation des électrons qu'ils
reçoivent.
On peut
citer :
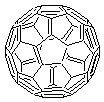
- Le fullerène C60 un des
premiers découvert ; c'est un ensemble de 60 atomes de carbone placés aux
sommets de 12 pentagones et 20 hexagones, l'ensemble formant une structure
semblable à celle d'un ballon de football.
- Le PC60BM
ou
Phényl, fullerène60-Butanoate de Méthyle formé à
partir de fullerène C60
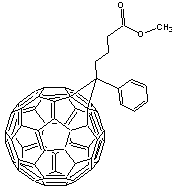
Remarque : l’ajout du
groupement substitué phényl-butanoate permet une bonne solubilité du PC60BM
dans une grande quantité de solvants organiques
- Le PC70BM Phényl,
fullerène70-Butanoate de Méthyle formé à partir de fullerène
C70 (70 atomes de carbone)
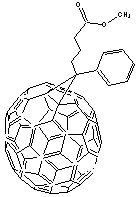
Il
existe aussi quelques polymères accepteurs comme par exemple :
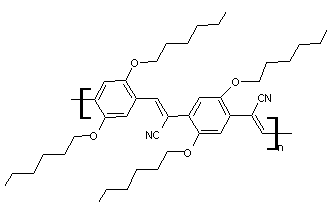
5-2) Donneurs
d'électrons :
Ce sont
des polymères divers ; leur caractère donneur d'électrons s'expliquant par la
présence de doublets d'électrons non liants dus à la présence d'atomes de
soufre, d'oxygène ou d'azote (transitions d'orbitales π -> π*,
σ -> σ* pour ces doublets) et par la présence de doubles liaisons
(transitions d'orbitales π -> π*).
on va
donner le motif de quelques-uns d'entr'eux :
|
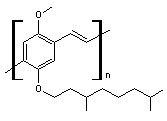
ou Poly[2-méthoxy-5-(3',7'-diméthyloctyloxy)-1,4'-phénylène
vinylène]. [C19H28O2]n N° CAS : 177716-59-5 |
|
|
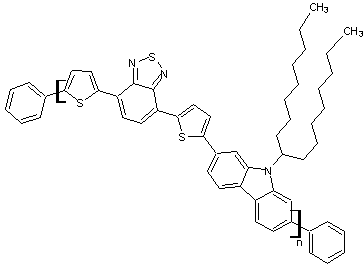
(C43H47N3S3)n
C12H10 Masse molaire : 20 000 à 100 000 Daltons UV : 390, 554 nm N° CAS : 958261-50-2 |
|
|
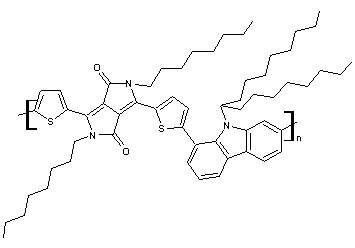
(C61H85N3O2S2)n
Masse
molaire : 10 000 à
50 000 Daltons UV : 647 nm N° CAS : 1147374-60-4 |
|
|
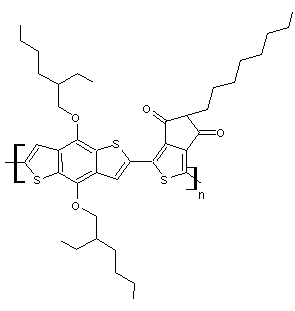
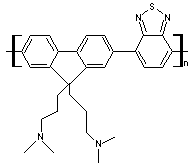
(C40H53NO4S3)n
N° CAS : 1223479-75-1 |
|
|
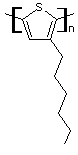
ou poly(3-hexylthiophène) (C10H18S)n
Fusion : 238°C N° CAS : 108568-44-1 Risques : |
|
|
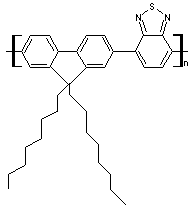
ou poly
(9,9-dioctylfluorène-co-benzothiadiazole) |
|
|
|
Appelées
aussi DSSC acronyme de Dye-sensitived solar cell , elles sont à
mi-chemin entre les cellules photovoltaïques à semi-conducteur et les cellules photovoltaïques
organiques ; elles sont inspirées de la photosynthèse et dissocient
l'absorption de la lumière et la séparation des charges.
Mises au
point en 1991 par Michael Grätzel de l'Ecole polytechnique fédérale de Lausanne
et son équipe, elles sont très diverses mais toutes ont un schéma global
semblable (D'après
"Les cellules Grätzel : L'avenir de la filière photovoltaïque ? Clément Girault – Ammanuel James –
Aurélien Monfort)

Une mince
couche de pigment photosensible est adsorbée à la surface de nanoparticules de
dioxyde de titane (TiO2) un semi-conducteur à large bande interdite
(DE = 3,2 eV), l'ensemble étant déposé
à la surface d'une électrode 1 transparente et conductrice. Entre les deux
électrodes 1 et 2, un électrolyte, par exemple une solution contenant des ions
iodures (I-) et des ions triiodures (I3-).
Lorsqu'un
photon hn traverse une des électrodes et
arrive sur le colorant, il cède son énergie à celui-ci qui passe dans un état
excité. La relaxation se fait par transfert de l'électron excité à la bande de
conduction du dioxyde de titane. Cet électron traverse la fine couche de TiO2
et arrive sur l'électrode puis dans le circuit électrique externe.
Le colorant
ayant perdu un électron est chargé positivement ; vis-à-vis de l'électrolyte
dans lequel il baigne il va jouer le rôle d'oxydant (accepteur d'électron). Il
va oxyder un ion iodure (I-) et le transformer en ion triiodure (I3-).Cet
ion est réduit au niveau de l'électrode 2 en ion iodure (I-), le
cycle rédox est ainsi bouclé et le système est revenu à son état initial
jusqu'au prochain photon.
En résumé :
- hn + Colorant àColorant*
- Colorant* à Colorant+ + e-
injecté dans TiO2 (Electrode 1)
- 2 Colorant+ + 3 I- à 2 Colorant
+ I3-
- I3- + 2e- à 3I-
(Electrode 2)
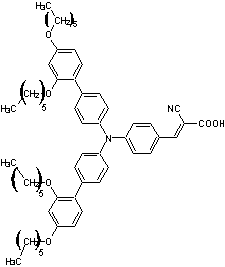
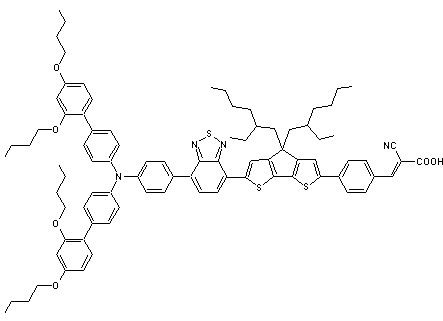
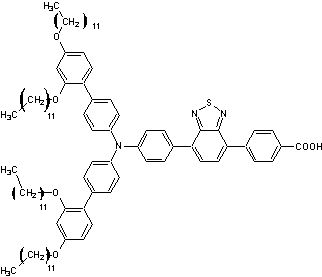
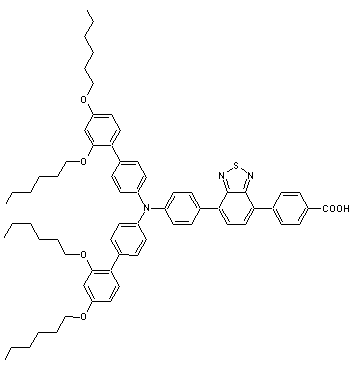
Des exemples
de pigments photosensibles (colorants) :
|
|
|
|
NT35 |
XY1b |
|
|
|
|
MS5 |
MS4 |