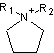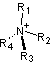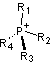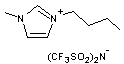LES LIQUIDES IONIQUES.
Gérard GOMEZ
1) Définition
2) Constitution
4) Bref historique et applications
5) Quelques liquides ioniques très utilisés
6) Préparations
1) Définition :
Les
liquides ioniques sont des sels ayant une température de fusion inférieure à
100°C (on verra que dans les faits, certains composés à point de fusion supérieur
seront quand même considérés comme liquides ioniques) ; cette température a été
prise arbitrairement ; c'est la température d'ébullition de l'eau sous la
pression atmosphérique normale.
Il est
à remarquer que beaucoup de ces composés qui ont des applications courantes
sont liquides à température ambiante.
Remarques :
- Le chlorure de sodium fondu, par
exemple n'entre pas dans cette catégorie car sa température de fusion (environ
800°C) ne répond pas à la définition.
- Une solution aqueuse de chlorure
de sodium non plus car les ions qu'elle contient ne sont pas ceux d'une
substance fondue.
Un
exemple de liquide ionique :
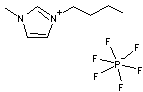
C'est
un sel (BMIM PF6) formé par l'association d'un cation 1-Butyl-3-Méthyl
IMidazolium (acronyme BMIM) et d'un anion hexafluorophosphate ; son
point de fusion est environ 8°C. Il est donc liquide à température ordinaire.
Des
centaines de liquides ioniques ont été décrits et la gamme des températures de
fusion, initialement restreinte, s'est considérablement étendue. Ainsi des sels
ayant une température pouvant descendre jusqu'à -96°C ont été récemment
découverts.
2) Constitution d'un liquide ionique :
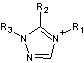
Il
existe de nombreux liquides ioniques ; ils sont formés par l'association
·
d'un cation, le plus souvent organique
(hétérocyclique) parmi les :
|
|
-
Alkylpyrrolidiniums
|
-
Alkylimidazoliums
|
-
Alkyltriazoliums
|
|
|
|
|
|
mais
aussi des cations tels que :
|
|
-
Tétraalkylphosphoniums
|
Remarque :
Des
cations portant des fonctions organiques telles que amines, alcools, éthers,
acides carboxyliques, nitriles …. ou encore des cations chiraux (voir annexe 2) ont été mis en œuvre.
·
D'un anion,
-soit inorganique
F-, Cl-, Br-, I-,
NO3-, ClO4-, CuCl2-
, AuCl4-, ZnCl3-, SnCl3-,
BF4-, PF6-, SbF6-,
AsF6-, AlxCl(3x+1)-
-
soit organique
CH3CO2-, CF3CO2-,
CH3C6H5SO3- (ion
tosylate ou TsO-), CF3SO3- (ion
triflate ou TfO-), (CF3-SO2)2N-
(ion bis(TriFluorométhane Sulfonyl) Imide ou TFSI), (F-SO2)2N-
(ion bis(Fluoro Sulfonyl) Imide ou FSI), BR4-, R3BOH-
…..
La
diversité des propriétés résultant de l'association d'un cation donné avec
différents anions et le nombre de combinaisons possibles fait dire de ces
liquides ioniques que ce sont des composés que l'on peut fabriquer "sur
mesure" pour une application donnée.
3) Principales propriétés des liquides ioniques :
Les
propriétés physico-chimiques sont très dépendantes de la pureté du produit et
varient beaucoup avec la présence d'eau ou d'ions halogénures.
Les
propriétés des liquides ioniques purs dépendent de la taille et de la nature
des ions qui les composent ; ainsi par exemple :
- avec des anions Cl-, Br-
ou trifluoroacétates ils sont hydrophiles (solubles dans l'eau)
- avec PF6- ou
bis(triflyl) amidure ils sont hydrophobes et forment deux phases liquides avec
l'eau.
·
Une des raisons qui explique leur
faible point de fusion, alors que leur nature ionique pouvait faire penser le
contraire, est que leurs constituants sont généralement asymétriques ; cette
asymétrie rend plus difficile leur arrangement en structure fortement ordonnée
avec, donc, un réseau de grande énergie. De fait, leur structure cristalline de
faible énergie entraîne un point de fusion relativement bas.
La distribution des
charges sur les ions est aussi un facteur intervenant sur le point de fusion.
Plus la taille des ions est importante et donc la charge délocalisée dans
l'espace et plus le point de fusion est bas. On remarque ce phénomène par
exemple, avec des structures aromatiques qui participent à cette
délocalisation.
·
Ils ont une forte viscosité ; elle
s'explique par les importantes interactions entre les ions qui les composent et
qui entraînent une moins grande mobilité de l'ensemble.
·
Ils ont une stabilité thermique et
chimique élevée.
Les liquides ioniques
ayant un anion faiblement nucléophile sont stables jusqu'à 400°C.
Ils sont
ininflammables sauf les nitrates et les picrates.
·
Ils sont bons conducteurs de
l'électricité.
La conductivité
ionique d'un électrolyte est l'aptitude qu'il a à se laisser traverser par un
courant électrique ; plus celle-ci est grande et meilleure est la qualité du
liquide ionique comme électrolyte. En général une forte viscosité diminue la
conductivité ionique. Ainsi EMIM-BF4
a une viscosité à 25°C de 25,7.10-3 Pa.s et une conductivité
à 25°C de 14 mS.cm-1 tandis que BMIM-BF4 (même anion avec
un groupement butyle à la place d'un groupement éthyle dans le cation) a une
viscosité à 25°C de 180.10-3 Pa.s et une conductivité à 25°C de 3,5
mS.cm-1 ; on voit donc qu'on a intérêt à utiliser des liquides
ioniques de faible viscosité si on les destine à être des électrolytes.
·
Ils possèdent une tension de vapeur
très faible et donc une faible volatilité qui permet une séparation facile des
produits dissous, par distillation, et évite une exposition aux vapeurs non
contrôlées.
On peut facilement
les régénérer et les recycler.
·
Ils sont relativement peu coûteux et
faciles à synthétiser.
Toutes ces qualités
vont dans le sens d'une chimie propre.
·
Leur toxicité dépend de leur
composition. Sont notablement toxiques ceux ayant PF6- comme
anion ou les ions imidazolium comme cation, la toxicité augmentant avec la
longueur des chaînes alkyles.
4) Bref historique et applications des liquides ioniques :
Le
premier liquide ionique recensé date du milieu du 19ème siècle ; il
apparaissait sous forme d'une huile rouge lors de la préparation du toluène à
partir du benzène par réaction de Friedel et Crafts (réaction du benzène sur le
monochlorométhane en présence de AlCl3 (Trichlorure d'aluminium)) ;
sa structure :
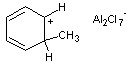
Le
premier liquide ionique synthétisé le fut en 1914 pendant la première guerre
mondiale par Walden et ses
collaborateurs qui cherchaient de nouveaux explosifs : le nitrate
d'éthylammonium (température de fusion : 12°C).
Il a
fallu attendre les années 1960-70 pour que des recherches soient faites dans ce
domaine par l'armée américaine qui voulait améliorer les caractéristiques des
électrolytes des piles thermiques (voir annexe 1); elles
ne furent pas couronnées de succès.
C'est
seulement dans les années 1990 que les cations dialkylimidazolium associés aux
anions nitrates, sulfates, acétates, tétrafluoroborates, hexafluorophosphates
commencèrent à avoir des applications pratiques dans les piles et les
batteries. C'est aussi à cette époque que l'on commence à les utiliser comme
solvants.
De nos
jours, ils trouvent de nombreuses applications dans beaucoup de domaines comme
par exemple la synthèse organique, la catalyse, la chromatographie,
l'électrochimie (électrolytes de batteries et dépôts métalliques), les
extractions (désulfuration des carburants par exemple ou extraction des
actinides des effluents de centrales nucléaires), les préparations de
nanoparticules, les additifs de polymères ….
5) Quelques liquides ioniques très utilisés :
On
commencera par les plus connus :
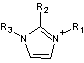
|
Nom |
Acronyme |
R1 |
R2 |
R3 |
|
1-Ethyl-3-méthylimidazolium |
EMIM |
C2H5 |
H |
CH3 |
|
1-Butyl-3-méthylimidazolium |
BMIM |
C4H9 |
H |
CH3 |
|
1-Hexyl-3-méthylimidazolium |
HMIM |
C6H13 |
H |
CH3 |
|
1-Octyl-3-méthylimidazolium |
OMIM |
C8H17 |
H |
CH3 |
|
1-Décyl-3-méthylimidazolium |
DMIM |
C10H21 |
H |
CH3 |
|
1,3-Dibutylimidazolium |
BBIM |
C4H9 |
H |
C4H9 |
|
1-Butyl-2,3-diméthylimidazolium |
BMMIM |
C4H9 |
CH3 |
CH3 |
Ces
cations pouvant être associés à n'importe lequel des anions cités au paragraphe 2.
Ainsi
par exemple
·
BMIM PF6

de
formule moléculaire C8H15F6PN2, de
densité 1,37, il est hydrophobe, a une viscosité dynamique de 285.10-3 Pa.s à 25°C (par
comparaison la viscosité de l'eau à 20°C est de 1.10-3 Pa.s) ; il
est soluble dans l'acétonitrile, l'acétone, le dichlorométhane, le THF, le DMSO
et est utilisé pour la synthèse, la catalyse, la séparation et l'extraction
ainsi qu'en biotechnologie (biocatalyse par exemple ou purification de
protéines).
Son point
de fusion : entre 6 et 10°C.
·
BMIM Acétate
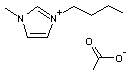
de
formule moléculaire C10H18N2O2, de
densité 1,02, il est hydrophile, a une viscosité dynamique de 440.10-3 Pa.s à 25°C ; il est
soluble dans l'eau, l'acétonitrile, l'acétone, le dichlorométhane et est
surtout utilisé pour la synthèse et la catalyse.
Son
point de fusion est inférieur à -20°C.
·
EMIM Méthyl-phosphonate,
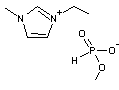
de
formule moléculaire C7H15N2PO3 il
est hydrophile, protique, a une viscosité dynamique de 107.10-3 Pa.s à 25°C ; il est
soluble dans l'eau, le méthanol, l'éthanol et est surtout utilisé en
biotechnologie et pour l'extraction.
·
EMIM–TFSI et BMIM-TFSI
|
|
|
sont
envisagés comme électrolytes pour les accumulateurs au sodium qui remplaceront
probablement les accumulateurs au lithium, avec une technologie comparable mais
utilisant le sodium, beaucoup plus abondant sur Terre.
On
citera aussi quelques sels relatifs aux autres cations :
- Sels d'ammonium
·
N,N-Diméthyl-N-éthyl-N-benzyl ammonium
pour le cation et Bis
(Trifluorométhanesulfonyl)imide pour l'anion :
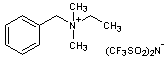
de
formule moléculaire C13H18F6O4S2N2 est un composé aromatique, hydrophobe
ayant une viscosité dynamique de 400.10-3 Pa.s à 25°C ; il est
utilisé pour la synthèse, la catalyse, la séparation et l'extraction.
·
N-Triméthyl-N-hexylammonium associé à
un ion bromure
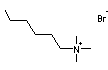
de
formule moléculaire C9H22NBr est un composé hydrophile,
soluble dans l'eau et est surtout utilisé en biotechnologie.
Son
point de fusion 182-184°C.
·
(N,N-diéthyl-N-méthyl-N-(2-méthoxyéthyl))ammonium
pour le cation et bis(fluorosulfonyl)imide
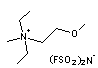
de
formule moléculaire C8H20F2N2O5S2
est un composé hydrophobe et est utilisé comme électrolyte de piles, de
batteries et de supercapacités (stockage d'énergie).
- Sels de phosphonium
·
Trihexyl(tétradécyl)phosphonium pour
le cation et l'anion chlorure
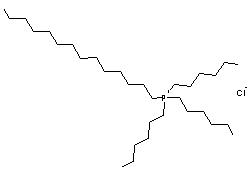
de
formule moléculaire C32H68PCl est un composé hydrophobe,
soluble dans l'hexane, le toluène, le diéthyléther, le dichlorométhane et le
THF, de densité 0,882 ; il a une viscosité dynamique de 1824.10-3
Pa.s à 25°C.
Son
point de fusion est -50°C.
Il est
utilisé en synthèse et en catalyse.
·
Trihexyl(tétradécyl)phosphonium pour
le cation et dicyanamide pour l'anion

de
formule moléculaire C34H68N3P est un composé
hydrophobe, soluble dans l'hexane, le toluène, le diéthyléther, le
dichlorométhane et le THF, de densité 0,898 ; il a une viscosité dynamique de
280,4.10-3 Pa.s à 25°C.
Son
point de fusion est -54°C.
Il est
utilisé en catalyse et en synthèse.
- Sels de pyrrolidinium
·
N-Butyl-N-méthylpyrrolidinium pour le
cation et bis(fluorosulfonyl)imide pour l'anion
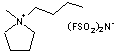
de
formule moléculaire C9H20S2O4N2F2
est un composé hydrophobe.
Son
point de fusion est -17,7°C.
Il est
utilisé dans le stockage d'énergie (super condensateurs).
·
N-Butyl-N-méthylpyrrolidinium pour le cation
et l'hexafluorophosphate pour l'anion
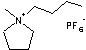
de
formule moléculaire C9H20F6NP est un composé
hydrophobe, soluble dans l'acétonitrile.
Son
point de fusion est 85°C.
Ses
applications sont multiples : en synthèse, en catalyse, en biotechnologie mais
aussi dans les séparations et les extractions.
- Sels de pipéridinium
·
N-méthyl-N-propylpipéridinium pour le
cation et bis(trifluorométhanesulfonyl)imide pour l'anion
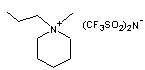
de
formule moléculaire C11H20F6N2 , de
densité 1, est un composé hydrophobe, soluble dans l'acétone et le
dichlorométhane.
Son
point de fusion est 12°C.
Sa
viscosité dynamique est 151.10-3 Pa.s à 25°C.
On
l'utilise en synthèse, en catalyse, pour les extractions et en biotechnologie.
Dans
les accumulateurs au lithium, il est peut-être appelé à remplacer l'électrolyte
actuel qui est, en général, de l'hexafluorophosphate de lithium LiPF6
en solution dans le carbonate d'éthyle,
6) Préparations des liquides ioniques :
Il
existe de très nombreuses préparations, qui dépendent de la structure des
liquides ioniques.
Nous
donnerons un exemple pour ceux de type N-alkylimidazolium.
v
Principe :
- On part d'une molécule de
N-alkylimidazole qu'on "quaternise"avec un halogénoalcane.
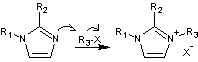
Remarque :
Il
s'agit d'une substitution nucléophile ; les halogénoalcanes les plus utilisés
étant les chloroalcanes, les bromoalcanes et les iodoalcanes ; La réaction
sera plus rapide dans l'ordre
I>Br>Cl. La longueur de la chaîne influencera aussi la vitesse ; plus la
chaîne sera longue et moins la vitesse sera grande.
- On peut ensuite changer par métathèse l'anion obtenu par
"quaternisation" (l'ion halogénure résultant de l'halogène de
l'halogénoalcane) afin d'obtenir le couple anion-cation recherché en fonction
des propriétés voulues.
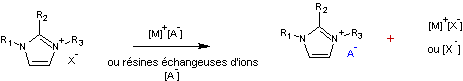
Remarque : l'échange d'anion
par résines est peu répandu pour les préparations à grande échelle.
v
Exemple :
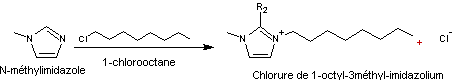
On peut
travailler au micro-ondes, puissance 240W (on chauffe puis on agite
alternativement toutes les 20 secondes) et on obtient un rendement de l'ordre
de 80% en moins de deux minutes.
Il faut
cependant remarquer que cette technique ne peut s'appliquer qu'à de faibles
quantités de réactifs.
On peut
travailler au bain d'huile à 100°C mais il faudra chauffer et agiter pendant au
moins 24h pour le même rendement.
Remarque : L'alkylation
décrite pour les liquides ioniques de type N-alkylimidazolium peut se
généraliser pour ceux de type alkylpyrrolidinium ou alkylphosphonium.
Annexe 1 : Principe d'une pile thermique
Une pile
thermique est constituée de plusieurs cellules associées, chaque cellule étant
elle-même formée :
- D'une anode, en général un alliage
de lithium.
- D'un séparateur qui est un
électrolyte : liquide ionique, solide à température ambiante.
- D'une cathode formée de sulfure de
fer (FeS2) par exemple.
Entre deux
cellules, des compositions chauffantes (Fe + KClO4) destinées à
maintenir l'électrolyte liquide, initiées par un inflammateur (Zr + BaCrO4)
quand on a besoin d'utiliser la pile.
Elles
peuvent se conserver des dizaines d'années sans s'altérer (elles ne
fonctionnent pas quand l'électrolyte est solide) et démarrent en quelques
dixièmes de seconde lorsqu'on souhaite les utiliser.
Elles sont
surtout utilisées dans le domaine militaire : systèmes de sécurité,
électronique embarquée dans des engins de natures diverses.
Annexe 2 : Utilité des liquides ioniques avec cations chiraux
On peut en
partant de deux réactifs non chiraux obtenir par réaction chimique une molécule
chirale, généralement sous forme d'un racémique c'est-à-dire un mélange
équimolaire des deux énantiomères.
On connaît
plusieurs façons de favoriser l'apparition d'un des énantiomères lors de la
réaction ; la synthèse est alors qualifiée d'asymétrique. L'excès
énantiomérique (ee) exprimé en % permet de quantifier la quantité de
l'énantiomère dominant qui excède la quantité de l'énantiomère opposé.
Parmi les
méthodes favorisant la formation d'un des énantiomères il y a l'utilisation
d'un solvant ayant un centre de chiralité.
On comprend
alors aisément l'intérêt de pouvoir utiliser comme solvant, un liquide ionique
avec cation chiral.
Un exemple
de cation chiral (placé entre crochets) d'un liquide ionique :
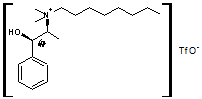
Il est
utilisé en synthèse asymétrique, par exemple dans la synthèse de Baylis-Hillman
:
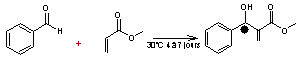
Le
catalyseur utilisé étant le 1,4-diazabicyclo[2,2,2]octane
![]()
encore
appelé DABCO.
L'excès
énantiomérique de cette réaction est 44%.