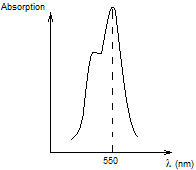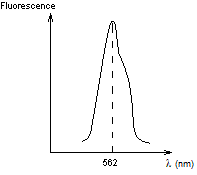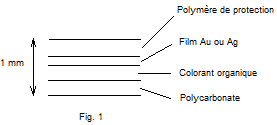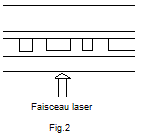DES COLORANTS POLYMETHINIQUES :
LES CYANINES.
Jacques
BARON
Plan de
l'étude :
A. Présentation
I. Définitions
2. Cyanines
3. Azacyanines
4. Mérocyanines
II. Nomenclature
1. Utilisation
du radical "méthine"
2. Utilisation
du radical "carbo"
3. Nomenclature
chimique simplifiée.
III. Cyanines et couleur
1. Absorption
de la lumière par les cyanines
2. Règles
3. Fluorescence
B. Applications
I. Teinture
II. Sensibilisation des émulsions photographiques
III. Cellules photovoltaïques organiques
V. Suivi de molécules organiques in-vivo
A. Présentation
I. Définitions
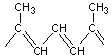
- Les polyméthines sont
des composés formés d'une série de groupements méthine =CH- reliés en une
chaîne de doubles liaisons conjuguées
![]()
Dans
une telle structure il peut y avoir délocalisation des électrons π,
résonance et, de ce fait, ce sont des colorants si le nombre de doubles
liaisons est suffisant : au moins 7 pour une absorption dans le visible
(violet)
- Cela pourrait rappeler
les caroténoïdes, la
molécule ayant une longue chaîne
cyclisée
aux deux extrémités. Mais les colorants polyméthiniques ont une particularité
supplémentaire : à une extrémité doit se trouver un accepteur d'électrons A et
à l'autre extrémité un donneur D.
![]()
Exemples
:
- Pour A
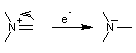
ou
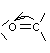
- Pour D
![]()
ou
![]()
- Ainsi il est mis en
jeu dans le système une délocalisation d'électrons π et d'électrons de
doublets non liants. Il en résulte une absorption pour des longueurs d'onde
bien plus élevées (rouge, IR) qu'en l'absence des sites A et D.
Exemple : avec 4 doubles
liaisons
|
|
λabs(max)
(nm) |
Couleur
du composé |
|
|
550 |
rouge |
|
|
314 |
incolore |
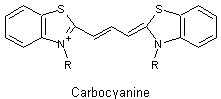
2. Cyanines
La
principale classe de ces colorants est celle dans laquelle on trouve en bout de
chaîne un atome d'azote, un des deux atomes N étant chargé positivement (azote
quaternaire).
Nous allons préciser ces formules.
Les
polyméthines azotés sont appelés cyanines parce que les plus anciennement
connus et beaucoup qui sont performants et très utilisés sont bleus. On parle
de polyméthines cyanés.
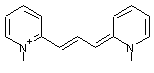
- Si la chaîne est
ouverte aux deux extrémités on les nomme streptocyanines
Exemple :
![]()
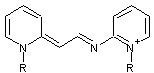
- Les cyanines ayant une
extrémité ouverte et une extrémité avec
un cycle azoté sont des hémicyanines
Exemple :
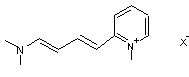
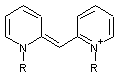
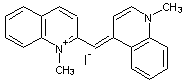
- Et les plus nombreuses
des cyanines sont celles dont les deux extrémités de la chaîne comportent un
noyau hétérocyclique azoté
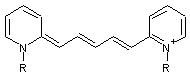
Exemple :
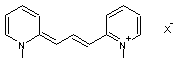
Elles
sont souvent symétriques, comme ici, mais les deux noyaux peuvent être de
natures différentes
Exemple :
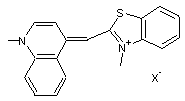
Principaux
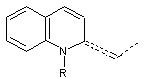
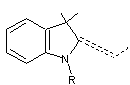
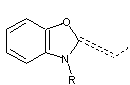
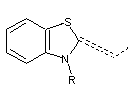
noyaux hétérocycliques des cyanines :
|
Quinoléine |
Indoline |
Benzoxazole |
Benzothiazole |
|
|
|
|
|
Les
cyanines ont une extrémité ionisée (N+ quaternaire).
Les
anions accompagnant ces structures sont :
halogénures
X- (le plus souvent iodures I-), perchlorate ClO4-,
sulfonate –SO3- (fixé sur la molécule elle-même).
Dans la
suite, ils seront souvent omis car leur nature influence peu, en général, les phénomènes
étudiés.
3. Azacyanines
Les
colorants polyméthiniques cyanés sont encore plus performants (nuances vives)
lorsqu'on introduit dans la chaîne un atome d'azote à la place d'un groupe
méthine. On les appelle azacyanines
Exemples :
|
|
|
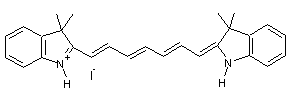
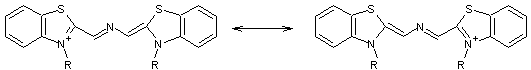
4. Mérocyanines
Il existe
des cyanines non ionisées
Exemple :
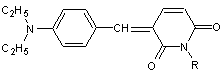
Mais
elles présentent quand même une dissymétrie qui engendre une certaine
polarisation.
On les
appelle mérocyanines.
Enfin,
il n'est pas inutile de préciser encore le vocabulaire, à cause d'une homonymie
(voir annexe 1.a).
II. Nomenclature
1. Utilisation du
radical "méthine"
D'après
le nombre de groupes méthine =CH-
Raisonnons
sur l'exemple simple suivant
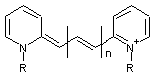
|
n |
Appellation méthine |
Nombre de C dans la chaîne |
Formule |
|
0 |
Monométhine |
1 |
|
|
1 |
Triméthine |
3 |
|
|
2 |
Pentaméthine |
5 |
|
On
remarque que le nombre de groupes méthine est impair. C'est encore le nombre de
carbones de la chaîne car les carbones successifs de celle-ci portent tous une
fonction méthine qu'on aborde par –CH= ou =CH-.
2. Utilisation
du radical "carbo"

|
n |
Désignation |
|
0 |
Cyanine |
|
1 |
Carbocyanine |
|
2 |
Dicarbocyanine |
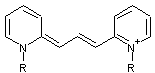
Les carbocyanines
les plus utilisées ont une chaîne à 3 =CH- et deux noyaux hétérocycliques
azotés
Exemple :
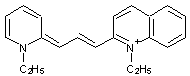
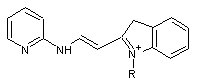
3. Nomenclature
chimique simplifiée
On utilise
le mot carbocyanine et la nomenclature des hétérocycles plus ou moins abrégée :
indo
pour indole, oxa pour benzoxazole, ….
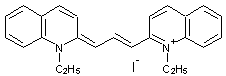
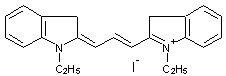
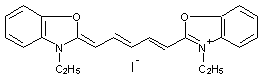
Exemples :
|
|
Iodure
de 1,1'-diéthylcarbocyanine Sous-entendu : de quinoléine. |
|
|
Iodure
de 1,1'-diéthylindocarbocyanine Sous-entendu
: indole. |
|
|
Iodure
de 3,3'-diéthyloxadicarbocyanine Sous-entendu
: benzoxazole. |
Lorsque
cela s'avère nécessaire on précise le point d'attache de la chaîne sur un noyau
|
|
Iodure
de 1,1'-diméthyl-2,4' cyanine Sous-entendu
: de quinoléine |
La
structure indocyanine est très répandue
|
|
Iodure
de 3,3,3',3'-tétraméthyl-2,2'-indotricarbocyanine. |
Outre
ce manque de précision, compensé par l'usage, il faut être attentif aux
utilisations du mot cyanine dans le cadre des colorants polyméthiniques (voir annexe 1.b)
III. Cyanines et couleur
1. Absorption de
la lumière par les cyanines
Considérons
deux formules simples de cyanines
|
|
|
L'azote
quaternaire
![]()
est accepteur
d'électrons.
L'atome
d'azote
![]()
avec
son doublet libre est donneur d'électrons.
La
délocalisation des électrons dans l'édifice est possible par transfert de
charges le long de la chaîne de doubles-liaisons conjuguées. L'absorption de
radiations peut fournir l'énergie nécessaire aux transitions.
On
constate que, pour les cyanines, cette absorption est possible sur toute
l'étendue entre l'ultraviolet et l'infrarouge, ce qui explique que ces composés
soient colorés.
2. Règles
Plusieurs
règles régissent ce phénomène :
- Quand le nombre n de
groupements méthine =CH- augmente d'une unité, la longueur d'onde du pic
d'absorption augmente de 100nm environ.
Exemple :
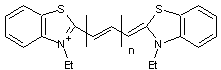
|
n |
λabs
(nm) |
|
0 |
423 |
|
1 |
557 |
|
2 |
650 |
|
3 |
768 |
- L'apparition d'un
cycle en bout de chaîne, c'est-à-dire le passage d'une chaîne ouverte à une chaîne
terminée par un hétérocycle azoté, entraîne une absorption vers de plus grandes
longueurs d'onde et l'intensité d'absorption augmente.
- La nature des
hétérocycles influence la longueur d'onde d'absorption. Il en va de même pour
les substituants sur les cycles.
|
λmax = 643 nm |
λmax = 681 nm |
|
|
|
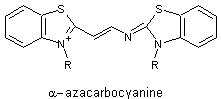
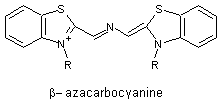
- Règle de Dewar
Un
phénomène difficilement prévisible a été observé lorsqu'un groupe =CH- de la
chaîne est remplacé par un atome électronégatif, en pratique N.
Si N
est l'atome qu'on retrouve en premier en quittant le cycle (position α)
l'absorption se déplace vers les longueurs d'onde plus courtes.
Si N
est en deuxième position (β), l'absorption se déplace vers les longueurs
d'onde plus élevées.
|
|
λabs |
|
|
580 nm |
|
|
480 nm |
|
|
620 nm |
Remarque :
Les
positions α, β, …. sont définies par rapport à l'un des cycles. Pour
les cyanines symétriques, ce peut être celui qui comporte N ou celui qui
comporte N+ car il y a
résonance.
3. Fluorescence
De
nombreuses cyanines sont fluorescentes.
Les
spectres ont presque tous la même forme

λabs pic d'absorption
λfl pic de l'émission de fluorescence
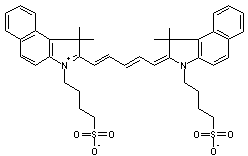
Exemple : dans le groupe des
indocyanines traditionnellement désignées par Cy3, Cy5,
Cy7 (c'est le nombre de carbones entre les deux cycles indoline)
|
|
|
λabs |
λfl |
|
Cy3 |
|
560 nm |
570 nm |
|
Sulfo-
Cy3 |
|
550 nm |
562 nm |
Le
phénomène est largement mis à profit en biologie et en médecine.
- La solubilité dans l'eau
nécessite la présence de groupements ioniques à la périphérie de la molécule,
généralement, on trouve le groupement –SO3-
|
|
|
|
|
Soluble
dans les solvants organiques (toluène, CH2Cl2,….) |
Soluble dans l'eau |
Soluble dans l'eau |
- Le pic d'absorption
est légèrement différent suivant le solvant utilisé
Par
exemple, pour l'hémicyanine suivante
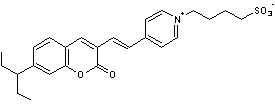
dans CH3OH λabs = 497 nm , dans
CH2Cl2 λabs
= 519 nm
Le solvant
influence aussi la fluorescence
dans CH3OH λfl = 650 nm , dans
CH2Cl2 λfl
= 619 nm
Nous
profiterons du choix de cette molécule pour noter que les études les plus récentes
consistent à observer les changements qui s'opèrent lorsqu'on crée des
complications sur ces molécules tout en respectant le plus possible la chaîne
polyméthinique.
B. Applications
I. Teinture
Les
carbocyanines étant particulièrement sensibles à la lumière ne peuvent être utilisées
en teinture ; leur tenue dans le temps aurait une durée insuffisante.
Par contre,
on obtient des teintures aux couleurs vives et de très bonne tenue avec les
azacyanines et les hémicyanines.
Ce sont des
colorants cationiques, encore appelés colorants basiques comme chacun sait.
Exemples :
|
Basic
Yellow 11 |
|
|
Basic Blue
41 |
|
Ils sont
particulièrement les bienvenus pour teindre les fibres acryliques (voir annexe 2)
Remarque :
On assiste à
une extension des possibilités de teinture par les colorants basiques, qui
étaient peu utilisés.
II. Sensibilisation des émulsions photographiques
La substance
fondamentale en photographie est un halogénure d'argent AgX. C'est une
substance qui ne capte que les radiations violettes et bleues.
Pour fixer
l'ensemble des radiations de la lumière envoyée par le sujet, il faut ajouter à
l'émulsion des sensibilisateurs qui doivent capter les autres radiations.
Les cyanines
font partie des molécules qui sont utilisées.
Exemple de sensibilisateur au rouge : le
pinacyanol
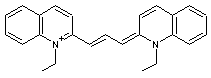
Il absorbe
le rouge ; c'est un produit bleu-vert.
Remarque :
Ce n'est pas
un alcool comme son nom pourrait le laisser penser.
Exemple de sensibilisateur au vert
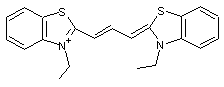
On peut même
avoir des cyanines sensibles à l'infrarouge jusqu'à 1300 nm, si la chaîne est
assez longue.
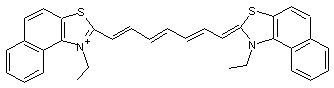
Mais un
grand nombre de cyanines ont été essayées et, parmi les plus efficaces, nous
avons les cryptocyanines (qui ont les atomes N en para de la chaîne
polyméthinique).
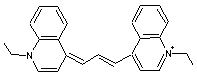
III. Cellules photovoltaïques organiques
Rappel du principe des cellules
photovoltaïques
On superpose
deux matériaux, l'un donneur d'électrons, l'autre accepteur d'électrons.
L'absorption
d'un photon affecte un électron du donneur lui faisant subir une augmentation
de niveau énergétique.
Il se crée
une paire électron-trou, appelé "exciton". Il y a diffusion du
phénomène. L'exciton se détruit au niveau de l'interface des deux matériaux.
L'accepteur
capte l'électron. Le phénomène engendre une tension, source de courant
électrique au niveau des deux électrodes.
A l'origine,
les matériaux ont été de nature minérale, notamment du silicium dopé. Ils sont
coûteux à mettre en œuvre, surtout à cause du degré de pureté requis.
On a tenté,
avec succès, de remplacer les donneurs par des composés organiques réputés pour
capter les rayons lumineux : des polymères (incolores) à nombreuses doubles
liaisons, sensibles le plus souvent aux ultraviolets et aussi des colorants.
On peut
citer l'hémicyanine
Les
électrons mis en jeu sont ceux des doubles liaisons (transitions π
->π*) et ceux des atomes N, S, O à doublets non liants
(transitions π ->π͌ ou σ ->σ͌).
Les cyanines
font partie des colorants organiques présents dans les disques compacts,
spécialement dans les CD-R
La structure
du disque est présentée dans l'annexe 3.
Le principe
fondamental de la gravure repose sur la photodégradation d'un colorant présent
dans le disque sous l'effet d'un faisceau laser (voir annexe
3).
Exemple de cyanine utilisée, accompagnée
des produits de sa photodégradation
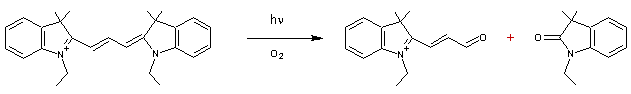
On admet que
l'oxygène du milieu intervient. Cette photo dégradation est en fait une
photo-oxydation.
La recherche
de produits toujours plus satisfaisants fait naître parfois des formules qui ne
sont pas parmi les plus simples.
par exemple :
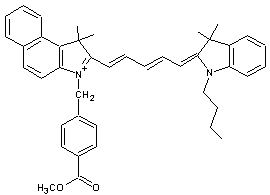
qui absorbe
très bien entre 500 et 650 nm.
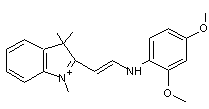
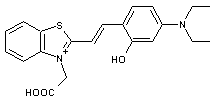
V. Suivi des molécules organiques in vivo
Il se trouve
que certaines cyanines sont fluorescentes comme il a été dit au paragraphe A.III.3
Nous pouvons
prendre à nouveau comme exemple la cyanine
|
|
|
|
Son maximum
d'absorption est à 550 nm ; elle émet un rayonnement de fluorescence avec un
maximum à 562 nm c'est-à-dire jaune vert. L'écart observé est appelé
"déplacement de Stockes".
S'il est
possible de lier chimiquement une cyanine fluorescente à une molécule organique
qu'on veut suivre dans l'organisme, en éclairant avec une longueur d'onde
convenable on pourra suivre le parcours de cette molécule en suivant la
fluorescence qui l'accompagne. On peut suivre avec des sondes, dans les
vaisseaux, dans un organe, ….
La longueur
d'onde de fluorescence dépend un peu du solvant et du substrat auquel est
associé la cyanine.
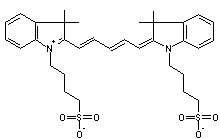
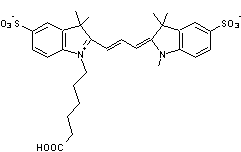
- En milieu biologique, nous sommes en présence d'une solution aqueuse
et les cyanines sont rendues solubles dans l'eau notamment en y greffant
des groupes sulfonates –SO3-
- Quant à la longueur
d'onde de fluorescence de la cyanine liée au substrat, on observe un léger
déplacement vers les grandes longueurs d'onde et une augmentation de
l'intensité d'émission.
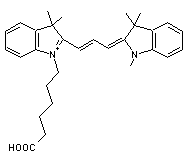
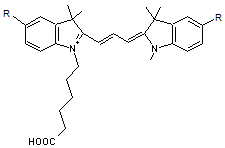
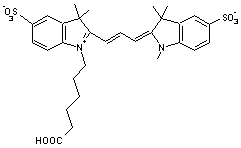
Parmi les meilleures cyanines
susceptibles de convenir, on peut citer les sulfoindocyanines dont les formules
sont
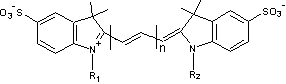
avec n = 1,2
ou 3
Le plus
souvent R1 est –CH2-CH2-CH2-CH2-CH2-COOH
et R2
est –CH3 .
D'autres
études ont porté sur
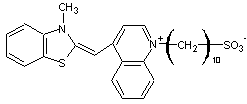
Pour finir,
nous évoquerons la manière dont la cyanine est reliée à la molécule biologique
étudiée.
Un cas
particulièrement important est celui des acides nucléiques
Rappelons qu'un
acide nucléique est constitué d'un enchaînement de 4 nucléotides comprenant
chacun les unités acide phosphorique, pentose et une base purique ou
pyrimidique.
Soit un
fragment d'un acide nucléique :
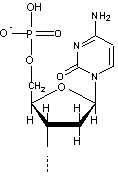
La liaison
avec une cyanine se fera au niveau de l'acide phosphorique et par
l'intermédiaire d'une des chaîne fixées sur l'azote de la cyanine.
Une des
chaînes assez connue est –(CH2)10-S-CH2-CH2-NH-.
En
représentant par P un point d'ancrage sur l'acide phosphorique de
l'acide nucléique dont nous avons représenté un fragment, on peut avoir la
structure suivante :
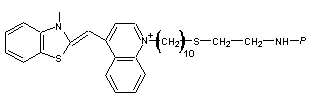
Une méthode de
destruction des cellules cancéreuses consiste à les traiter par l'oxygène
singulet car c'est un oxydant très puissant.
L'oxygène
singulet est une forme particulière d'oxygène qui peut être engendrée par
action d'un sensibilisateur sur l'oxygène ordinaire. Un sensibilisateur dans ce
cas est un composé absorbant l'énergie lumineuse dans un domaine de longueur
d'onde assez étroit et donnant lieu à une émission de fluorescence.
Soit S la
molécule de sensibilisateur.
Sous l'effet
d'un laser, cette molécule est excitée
![]()
Elle
transmet son excès d'énergie à l'oxygène ordinaire O2 qui prend
alors la forme particulière d'oxygène singulet.
On écrit

Ces
notations sont justifiées en annexe (voir annexe 4).
Il faut donc
trouver des molécules susceptibles d'être incorporées sélectivement dans les
cellules cancéreuses.
D'une façon
pratique, pour traiter certains cancers de la peau, on applique sur les zones
qu'on souhaite traiter, une crème photosensibilisante (qui contient donc le
sensibilisateur) qu'on laisse entre 3 et 6h.
Au fil du temps
le sensibilisateur se retire de la plupart des cellules saines, mais demeure
dans les cellules cancéreuses, car celles-ci l'éliminent moins rapidement. On
expose la région à une lumière laser de faible intensité pendant moins d'une
heure.
La destruction
des cellules cancéreuses a alors lieu, par oxydation par l'oxygène singulet qui
en résulte.
On sait que
les grandes longueurs d'onde favorisent la pénétration dans les tissus. Les
cyanines peuvent être de très bons sensibilisateurs car bleues ou vertes, elles
absorbent dans le rouge et certaines, mieux encore, dans l'infrarouge (il faut
pour cela une chaîne assez longue).
Il existe un
certain nombre d'indocyanines qui répondent aux conditions requises pour la
thérapie photodynamique.
Nous
citerons l'indocyanine green (ICG)
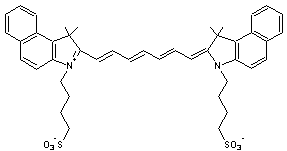
Remarque :
La thérapie
photodynamique est une thérapie photochimique, mais ce n'est pas l'expression
qui a été consacrée par l'usage.
Annexe
1 Vocabulaire concernant les cyanines
a) Homonymie
Les
cyanines constituent un groupe très important de colorants polyméthiniques. La
chaîne se termine aux deux extrémités par de l'azote, le plus souvent par un
hétérocycle azoté.
Il
existe une deuxième signification du mot cyanine, toujours dans le domaine des
colorants, mais qui se rapporte à des composés très différents.
Ces
composés sont responsables des couleurs rouges et bleues de nombreuses fleurs
(coquelicot, bleuet, géranium, ….) ou de certains fruits (fraise, framboise,
cerise, ….). On les regroupe sous l'appellation d'anthocyanines.
Le
noyau fondamental de ces colorants est le cation flavylium
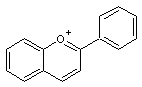
Ces
colorants se trouvent sous forme de glycosides.
Or, le
plus connu de ces hétérosides, présent dans le bleuet entre autres, est
couramment appelé cyanine.
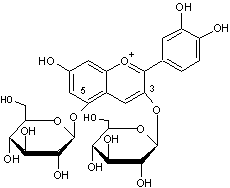
C'est
un 3,5-diglucoside.
La
partie aglycone, responsable de la couleur se nomme cyanidine.
b) Utilisations
particulières du mot cyanine dans le cadre des colorants polyméthiniques
- Comme vu à propos de
la nomenclature (paragraphe 2) le mot cyanine désigne une carbocyanine à un
seul groupement méthine.
- En outre, en langage
courant, il peut servir à désigner la 1,1'-di-isoamyl-4,4'-cyanine
(sous-entendu de quinoléine) qui est le "bleu de quinoléine", parce
que c'est une des premières cyanines synthétisées :
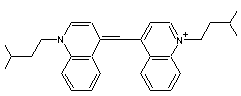
Formule
du bleu de quinoléine.
qui est
à la base des fibres acryliques. Ce n'est pas un composé très réactif pour les
méthodes de teinture traditionnelles. On s'arrange pour introduire dans la
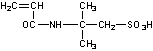
chaîne de polyacrylonitrile (PAN) un composé sulfoné : l'AMPS.
|
PAN |
Polyacrylonitrile |
|
|
AMPS |
Acide
2-acrylamido-2-méthylpropane sulfonique |
|
On fait
une copolymérisation
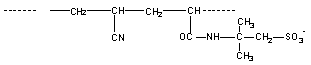
Il se
trouve que les azacyanines et les hémicyanines donnent des résultats
remarquables avec ce polyacrylonitrile modifié.
Annexe 3 Les disques compacts CD-R
Les CD-R
sont des disques qui ne contiennent pas de données lorsqu'ils sont vendus au
consommateur.
Leur
structure est représentée figure 1.
|
|
|
Gravure
Lorsque
l'utilisateur veut y inscrire des données, il fait agir un graveur CD. C'est un
faisceau laser, la longueur d'onde étant de l'ordre de 600 nm. L'action du
laser, modulé par le signal, se traduit par des destructions locales du
colorant au cours du défilement. Il s'ensuit des creux dont les dimensions et
la répartition sont fonction des caractéristiques des signaux à enregistrer (figure
2).
Remarque :
Les signaux à enregistrer, traduits en courant électrique au départ, sont
transformés par un dispositif électronique en signaux analogiques : Ce sont ces
derniers qui commandent le laser.
Lecture
La restitution
des données s'effectue en faisant arriver sur la succession de creux un
faisceau laser et les variations de lumière sont transformées par un
cheminement inverse en impulsions électriques.
Annexe 4 L'oxygène singulet
Le diagramme
des orbitales du dioxygène O2, au niveau 2p est le suivant

Le transfert
d'énergie par le sensibilisateur excité a pour effet de modifier la répartition
des électrons des orbitales πx et πy.
Il y a un retournement de spin donnant
![]()
On dit que
la molécule d'oxygène ordinaire est dans un état triplet parce que, à cause des
spins s = +1/2 et s = +1/2 des électrons des orbitales πx et
πy la quantité 2s+1 de la règle de quantification est égale à 3
et on adopte la notation (3)O2.
La
perturbation, en créant les spins s = +1/2 et s = -1/2 entraîne 2s+1 = 1. On
écrit (1)O2 et on parle d'état singulet.