DES PROTEINES FLUORESCENTES
ou FP
Gérard GOMEZ
avec la collaboration de
Jacques BARON
Plan de l'étude
1) Lumière bleue
émise par Aequorea victoria
2)
La lumière verte émise par Aequorea victoria
3)
Relation entre lumière bleue et lumière verte
4)
La GFP utilisée comme marqueur
5)
Des protéines fluorescentes de différentes couleurs
6)
Des Protéines Fluorescentes Réversiblement Photocommutables
1) Lumière bleue émise par Aequorea victoria
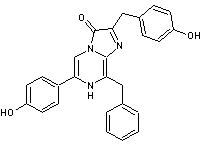
La
méduse Aequorea victoria émet une lumière bleue, due à une protéine
l'Apoaequorine qui s'associe à une luciférine, la coelentérazine dont la
molécule est donnée ci-après
Cet
ensemble porte le nom d' Aequorine et en présence de calcium et de dioxygène il
émet une lumière bleue (460<λ<480nm) sans avoir besoin d'une excitation
lumineuse.
Le
processus serait le suivant :
En
présence de calcium la protéine change de conformation, permettant l'oxydation
de la coelentérazine par le dioxygène suivie d'une ouverture du cycle
pentagonal puis d'une perte de CO2 ; on aboutit à la coelentéramide
comme l'indique la suite ci-dessous où seule la coelentérazine a été
représentée :
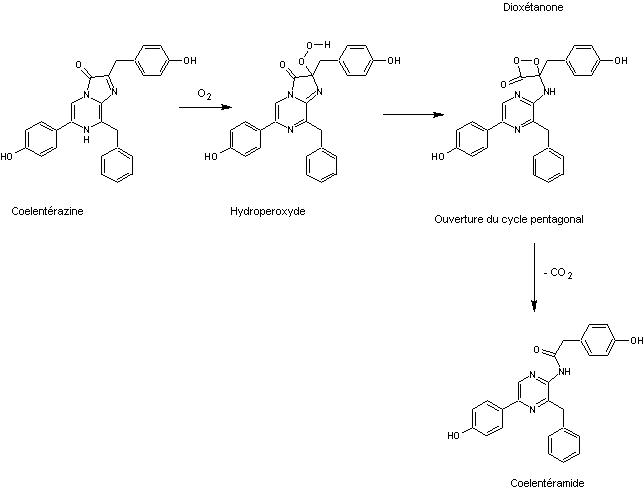
La
coelentéramide est obtenue sous forme excitée ; le retour à l'état stable s'accompagne
d'une émission de lumière bleue de longueur d'onde λ = 468 nm.
On peut
résumer cette suite d'étapes :
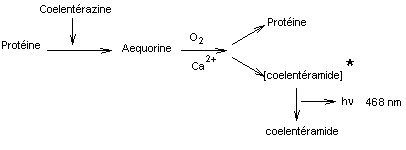
Remarque :
L'intensité
de la lumière émise dépend de la quantité d'ions Ca2+ présente.
Une
équipe du CNRS (Bertrand Lambolez du laboratoire Neurobiologie des processus
adaptatifs, Université Paris VI) a montré en 2006 la manière dont le calcium
régule l'émission de lumière : "la sensibilité de l'aequorine repose non
pas sur une augmentation de son rendement mais sur celle de la vitesse de la
réaction de bioluminescence qui se produit à rendement constant". Les
chercheurs supposent que "l'aequorine existe en équilibre entre deux
formes émettrices de lumière possédant des vitesses d'émission différentes. La
forme lente serait majoritaire à faible concentration en calcium et, lorsque
cette dernière augmente, l'équilibre serait déplacé en faveur de la forme
rapide."
2) La lumière verte émise par Aequorea victoria
On
observe aussi dans la lumière émise par la méduse, une composante verte de
longueur d'onde 508 nm, de plus faible intensité et qui correspond à une
fluorescence.
Les
lauréats du prix Nobel de chimie Shimomura, Chalfie et Tsien ont apporté
beaucoup dans l'étude de ce phénomène.
C'est
le Professeur Osamu Shimomura, qui met en évidence en 1962 la protéine
responsable de cette fluorescence, la GFP (Green Fluorescent Protein) et en
explique le mécanisme en 1971.
Cette
protéine, qui s'associe à l' Aequorine, est formée d'une seule chaîne de 238
acides aminés ; onze feuillets β sont disposés en tonneau (diamètre 2,4 nm
et longueur 4,2 nm) :
|
Structure
en tonneau
(β barrel) (Source
PDB - GFL) |
|
Vue
dans l'axe du cylindre (Source
PDB - GFL) |
Une
hélice α traverse le centre du cylindre que constitue le tonneau. C'est
sur cette hélice que se trouve le chromophore à l'origine de la couleur verte.
On
rappelle qu'un chromophore est un ensemble d’atomes à l’origine de la couleur
d’une entité
moléculaire et, par extension et plus généralement, à l’origine d’une transition
électronique donnée.
C'est
en 1979 qu'a été découverte la structure du chromophore :
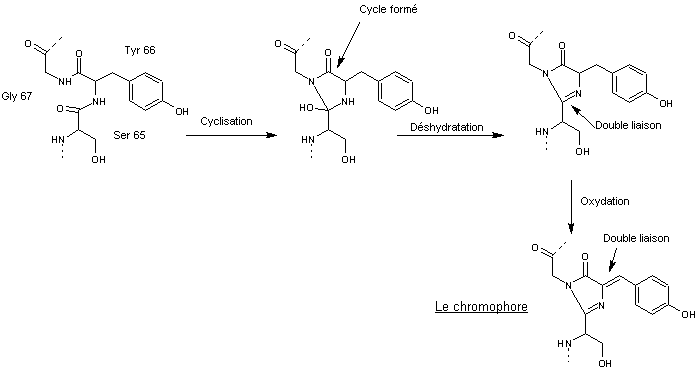
Il y a
réaction entre 3 acides aminés de la séquence, sérine 65 (Ser65), tyrosine 66
(Tyr66), glycine 67 (Gly67).
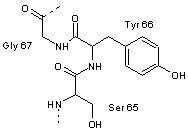
Remarque : Les liaisons en
pointillés représentent les connexions à la chaîne polypeptidique
La
sérine
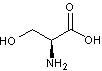
forme
une liaison covalente avec la glycine
![]()
aboutissant
à un cycle imidazole
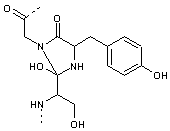
Cette
structure subit ensuite une réaction de déshydratation.
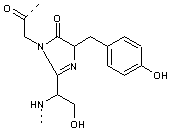
Elle
subit ensuite une oxydation en présence de dioxygène (cette réaction ne peut
donc avoir lieu en conditions anaérobies) pour former le chromophore :
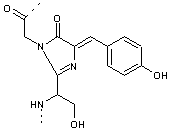
En
résumé les étapes conduisant au chromophore à partir des 3 acides aminés de la
chaîne en hélice qui traverse le cylindre sont :
3)
Relation entre lumière bleue et lumière verte :
Entre
1969 et 1971, Shimomura décrit, avec son équipe, le mécanisme de cette
luminescence. Il s'agit d'une action concertée ; l'aequorine en présence de
calcium et de dioxygène émet une lumière bleue (460<λ<480nm) sans
avoir besoin d'une excitation lumineuse ; cette lumière est absorbée par
la GFP ; le chromophore qui s'est formé au sein de cette protéine, est
excité et en se désexcitant restitue une lumière verte de plus grande longueur
d'onde (508 nm) ; c'est donc bien une fluorescence qui est à l'origine de la
formation de cette lumière par la GFP.
4)
La GFP utilisée comme marqueur :
La GFP
permet de suivre différents processus biologiques et chimiques à l'intérieur
d'une cellule ; en la connectant à une des protéines cellulaires, on peut
suivre les mouvements de celle-ci, ses interactions donc son comportement au
sein des cellules. Il suffit de soumettre les cellules à observer à une lumière
bleue (ou UV (396 nm) car la fluorescence a lieu aussi avec une lumière
excitatrice UV) pour suivre ses évolutions en observant la brillance verte résultant
de la fluorescence de la GFP associée.
Dans
les années 1990, Martin Chalfie a l'idée d'utiliser la GFP (Green Fluorescent
Protein) comme marqueur biologique pour dresser la carte du Caenorhabditis
elegans, un ver non parasitaire d'un millimètre environ constitué de 959
cellules seulement et possédant un cerveau, qui sert de modèle en génétique et
qui est transparent.
Il
attache le gène codant pour la GFP à ceux codant pour d'autres protéines ;
quand une cellule a besoin d'une protéine, elle active le gène correspondant ;
si celui-ci est attaché au gène codant la GFP, cette protéine est aussi
produite et on pourra donc en suivant la fluorescence de la GFP voir quelles
cellules produisent cette protéine et en quel endroit de la cellule cette
production a lieu.
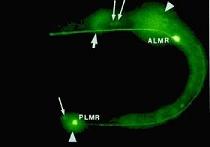
C'est
ainsi qu'est inséré le gène de la GFP au niveau des neurones impliqués dans la
perception tactile de Caenorhabditis elegans ; dans la figure ci-après
(image fournie par Chalfie et collaborateurs) on voit les deux récepteurs
neuronaux du toucher du ver ALMR et PLMR
marqués et tracés grâce à la GFP.
5)
Des protéines fluorescentes de différentes couleurs :
Roger Tsien
développe des protéines émettant des couleurs autres que le vert (d'abord dans
différentes teintes de jaune et de bleu puis plus tard, avec d'autres
chercheurs, le rouge) avec plus d'intensité et plus longtemps.
Pour
cela il échange différents acides aminés de la GFP.
- Ainsi la protéine S65T-GFP diffère
de la GFP dite "sauvage" par le remplacement de la sérine 65 par une
thréonine. Le chromophore est donc formé par Thr65-Tyr66-Gly67 :
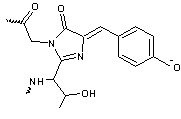
Contrairement
à la GFP sauvage pour laquelle les deux formes neutre (donc –OH pour le phénol)
et anionique (donc –O-) coexistent en quantité égale, la forme
anionique prédomine pour la protéine S65T-GFP.
La conséquence
est que pour la GFP sauvage, il existe deux bandes d'absorption centrées autour
de 396 nm (forme neutre) et 475 nm (forme anionique) et deux bandes très
voisines d'émission de fluorescence vertes, 508 nm pour la forme neutre et 503
nm pour la forme anionique, tandis que pour la S65T-GFP il existe deux bandes
d'absorption centrées autour de 394 nm (forme neutre) et 488 nm (forme
anionique) cette dernière étant nettement plus importante et pratiquement une
seule bande de fluorescence verte à 510 nm correspondant à l'irradiation de la
forme anionique.
- La YFP protéine
fluorescente jaune a un chromophore formé de Gly65-Tyr66-Gly67
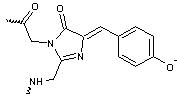
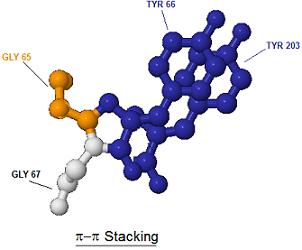
Remarque : La fluorescence dans le jaune s'explique par une
interaction entre le noyau phénolate du chromophore et un résidu de la tyrosine
placée en 203 dans la chaîne protéinique ; cette interaction non covalente
entre noyaux aromatiques est appelée π-π stacking.
La
forme neutre du chromophore absorbe à 392 nm et la forme anionique à 514 nm.
La
fluorescence due à la forme anionique se situe à 528 nm.
- On a travaillé sur d'autres protéines
fluorescentes appartenant à d'autres organismes marins, des coraux, des hydres.
Elles ont toutes une structure similaire à celle de la GFP. C'est le cas en
particulier de la protéine désignée par DsRed (son nom vient
de ce que la première protéine de ce type a été trouvée dans Discosoma
striata, un corail champignon) qui émet une fluorescence rouge.
Remarque :
Les
courbes d'excitation et d'émission de la DsRed sont les suivantes :
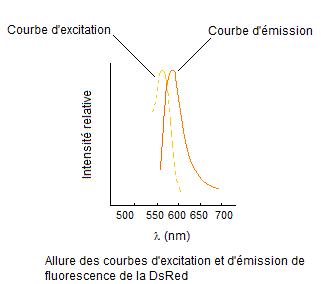
On
s'aperçoit que la lumière d'excitation se superpose à la lumière émise par
fluorescence jusqu'à environ 600 nm. Pour observer la lumière de fluorescence
seule, il faut donc se placer au-delà de cette valeur. Dans la pratique on
place un filtre 610 nm qui arrête toutes les radiations de longueur d'onde
inférieure, c'est-à-dire celles de la lumière d'excitation et une partie de la
lumière de fluorescence.
La
lumière observée est donc bien dans le rouge (sa longueur d'onde étant
supérieure à 610 nm) ; c'est pourquoi bien que le maximum d'intensité de
fluorescence soit à 583 nm c'est-à-dire dans le jaune, on dit que la DsRed émet
de la lumière rouge.
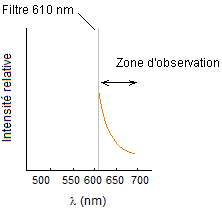
Bien
qu'on ne soit pas au pic d'émission, la courbe montre que l'intensité lumineuse
est encore suffisamment importante pour qu'on voie la protéine.
Son
chromophore correspond aux acides aminés 66-67-68 ; ce sont la glutamine 66
(Gln66) la tyrosine 67 (Tyr67) la glycine 68 (Gly68) :
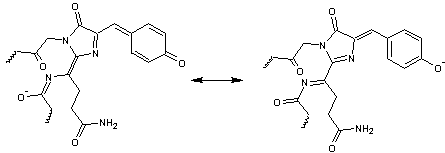
La
formation de ce chromophore au sein de la protéine est la suivante :
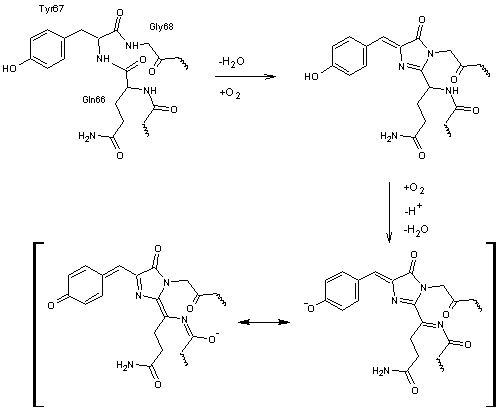
Actuellement
une centaine de ces protéines fluorescentes dérivées de la GFP ou de la DsRed
permettent d'accéder à un spectre de couleurs allant de 456 à 655 nm, soit du
violet au rouge.
L'intérêt
de pouvoir avoir des chromophores permettant la fluorescence à différentes
couleurs est que l'on peut suivre en même temps le trajet de différentes
protéines, si chacune d'elles est affectée d'une couleur différente de celle
des autres.
Exemple :
La
photographie ci-dessous (Livet et collaborateurs) fait apparaître des fibres
nerveuses colorées différemment après modification génétique des cellules
nerveuses correspondantes au sein du cerveau d'une souris. Cette expérience a été appelée "The brainbow"
contraction de brain (cerveau) et rainbow (arc en ciel).

6)
Des Protéines Fluorescentes Réversiblement Photocommutables
Ces
RSFPs (Reversibly Photoswitchable Fluorescent Proteins) correspondent à des protéines dont le chromophore est
activable de manière totalement réversible ; l'expérimentateur peut selon la
nécessité de son travail rendre fluorescente la protéine ou au contraire faire
cesser cette fluorescence par simple irradiation ; c'est un véritable
interrupteur de fluorescence.
Ainsi
le chromophore d'une protéine "Dreiklang" (en français "triple
accord") a la particularité de pouvoir additionner réversiblement une
molécule d'eau ainsi qu'indiqué ci-dessous
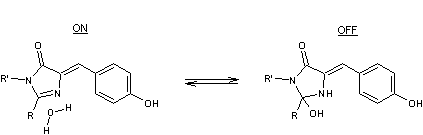
La photo-réversibilité des états
(extinction ou allumage) pouvant se faire à 365 nm et 405 nm, tandis que
l'excitation de fluorescence a lieu à 515 nm (la lumière émise par fluorescence
se situant,elle, à 527 nm).
On lit sur un article d'information
du département chimie de l'ENS (10 mai 2017) :
"Au sein de cette famille de
RSFPs, le génie biochimique a récemment mis au point la
protéine « Dreiklang », dont la particularité est de découpler
excitation de fluorescence et photo-réversibilité, ce qui permet de
mieux contrôler l'état ON ou OFF. Les études de
cristallographie par diffraction de rayons X montrent que cette
propriété est liée à une réaction de
photocommutation unique parmi les RSFPs, fondée sur l'addition
réversible d'une molécule d'eau sur le chromophore. Dans un article
paru dans Journal of Physical Chemistry Letters, le Pôle de Photochimie
Ultrarapide du Département de Chimie de l’ENS (UMR 8640 PASTEUR– ENS/CNRS/UPMC)
rapporte la première étude résolue en temps de la
photo-réversibilité de Dreiklang et propose un mécanisme pour
la réaction d'hydratation du chromophore. En utilisant la spectroscopie
d'absorption transitoire femtoseconde en bande large, les chercheurs montrent
que la réaction est déclenchée par la déprotonation
ultra-rapide du groupe phénol du chromophore à l'état
excité, en 100 fs. Ils proposent que l'éjection du proton conduit à
un transfert de charge du groupe phénol vers la partie imidazolinone, qui
déclenche à son tour la protonation de l'imidazolinone par un
résidu acide glutamique voisin et catalyse l'addition de la
molécule d'eau.
Ces résultats représentent une avancée significative dans la
compréhension de la photochimie unique de Dreiklang. Ils ouvrent la voie
vers la conception de nouvelles RSFPs plus performantes, que les biochimistes
façonneront à leur convenance selon les besoins en termes
d’excitation et/ou de réversibilité."