AZURAGE - BLANCHIMENT
Gérard GOMEZ
avec la collaboration de
Jacques BARON
Plan de
l'étude :
1) Définitions
2) Notions générales
sur la lumière
2-1)
Perception de la lumière provenant directement d'une source
2-2) Perception de la lumière après réflexion sur une surface
3) L'azurage
3-1) Une substance bleue
ajoutée lors du lavage
3-2) La fluorescence dans le
bleu
5)
Le blanchiment photochimique
Annexe 1
Réactions colorées de l'orseille
Annexe 2
L'indigo
Annexe 3
Chromophore et auxochromes
Annexe 4
Dégradation d'un colorant azoïque par exposition à la lumière
Annexe 5
Destruction du groupe azo d'un colorant azoïque par un oxydant comme le
peroxyde d'hydrogène
Un
textile naturel (chanvre, lin, coton) possède une légère coloration jaune pâle.
On peut souhaiter le rendre blanc et pour cela procéder à une opération appelée
azurage (ou blanchiment optique) qui consiste à superposer une couleur qui
s'additionnant à celle du matériau naturel donnera la couleur blanche.
On peut
vouloir faire disparaître des taches foncées sur un support blanc (tissus,
dents, …) ; une des solutions est l'action d'un réactif ; c'est ce qu'on
appelle le blanchiment chimique.
Les
supports colorés (textiles teints, tableaux d'art, façades ou surfaces peintes)
voient leurs couleurs pâlir par exposition au soleil ou à une forte luminosité
; c'est ce qu'on appelle le blanchiment photochimique.
2)
Notions générales sur
la lumière :
Pour
bien comprendre la technique dite d'azurage, il faut posséder quelques notions
simples sur la lumière et certains phénomènes lumineux.
2-1) Perception
de la lumière provenant directement d'une source :
La
lumière blanche est produite par des sources vibrant à des fréquences variant
entre 790 THz (1 THz =1012 Hz) et 385 THz ; ces vibrations se
propagent, formant des ondes qui dans l'air ont des longueurs d'onde (λ)
variant entre 380 nm (1 nm = 10-9 m) et 780 nm.
L'ensemble
de ces ondes superposées forme la lumière visible ; elle est blanche pour
l'humain qui la reçoit.
A
chaque fréquence de la source, donc à chaque longueur d'onde émise, correspond
une couleur ; ainsi, dans l'air, l'œil perçoit :
|
Entre
380 et 430 nm |
Du
violet |
|
430 -
450 nm |
Indigo |
|
450 -
500 nm |
Bleu |
|
500 -
565 nm |
Vert |
|
565 -
590 nm |
Jaune |
|
590 -
625 nm |
Orangé |
|
625 -
780 nm |
Rouge |
Remarque : La lumière visible
fait partie d'une famille très vaste d'ondes appelées ondes électromagnétiques.
Celles
qui jouxtent le domaine visible sont :
- pour
λ<380 nm les radiations UV (Ultra Violettes)
- pour
λ>780 nm les radiations IR (Infra Rouges)
Les UV
transportent une plus grande énergie que les radiations visibles ; les IR une
énergie plus faible.
2-2) Perception
de la lumière après réflexion sur une surface :
Lorsqu'on
éclaire une surface par de la lumière blanche, celle-ci est :
- Soit entièrement réfléchie et
cette surface apparaît blanche à l'observateur
- Soit entièrement absorbée et la
surface apparaît noire.
- Soit partiellement absorbée et la
surface est alors colorée.
La
couleur dépend des longueurs d'onde réfléchies donc de celles qui parviennent à
l'œil de l'observateur ; Les couleurs retenues par la surface sont dites
complémentaires de celles-ci.
Dans le
tableau ci-dessous figurent respectivement, les plages d'absorption en
longueurs d'onde, la couleur correspondant à cette absorption et la couleur de
la surface, c'est-à-dire la couleur perçue.
|
Plages
d'absorption |
Couleur
absorbée |
Couleur
perçue |
|
380 –
430 nm |
Violet |
Jaune
vert |
|
430 –
450 nm |
Indigo |
Jaune |
|
450 –
500 nm |
Bleu |
Orangé |
|
500 –
565 nm |
Vert |
Rouge |
|
565 – 590
nm |
Jaune |
Indigo |
|
590 –
625 nm |
Orangé |
Bleu |
|
625–
780 nm |
Rouge |
Vert |
2-3)
Notions de fluorescence :
Certaines
molécules, que l'on soumet à des radiations UV, absorbent l'énergie de ces
radiations et en restituent très rapidement une partie sous forme de lumière
visible.
- Premier exemple :
|
|
Une
solution de quinine est normalement transparente et incolore. Quand on
l'éclaire avec un laser UV, on voit la lumière bleue émise par fluorescence
de la molécule de quinine (λ fluorescence = 450 nm) sur le
trajet du faisceau UV. |
Molécule
de quinine
:
- Deuxième exemple :
|
|
Une
solution diluée d'éosine a une couleur rouge (maximum d'absorption à 524 nm)
; Si on l'éclaire avec une radiation UV, la couleur observée devient jaune. |
|
C'est
la fluorescence des molécules d'éosine (λ fluorescence = 545
nm) qui a modifié la couleur. |
Molécule
d'éosine
:
Photos : Captures d'écran (Espace des Sciences – Julien Fade – Institut
de physique de Rennes)
3) L'azurage :
Le principe est simple : les fibres naturelles ont une couleur
jaune pâle ; on en déduit qu'elles absorbent partiellement la lumière blanche
dans un domaine de longueurs d'onde se situant entre 430 et 450 nm, c'est-à-dire dans le bleu
profond (indigo).
Pour les rendre blanches, il suffit d'accrocher aux fibres une
substance bleue ou une substance produisant par fluorescence de la lumière
bleue ; on compense ainsi le bleu absorbé par la fibre et on reconstitue la
lumière blanche.
Azur signifie bleu intense ; c'est par référence au bleu ajouté
que l'on a donné à la technique le nom d'azurage.
Les agents azurants sont désignés en anglais par OBA (Optical
Brightners Agent).
Deux solutions pour produire du bleu :
3-1) Une substance bleue ajoutée lors du lavage :
Dans la vie courante, on ajoutait une "boule de bleu" au
sortir de la lessiveuse, au moment du rinçage.
Ces matières ont été utilisées aussi à l'échelle industrielle :
- Le bleu
Guimet
Parmi les substances qui ont été utilisées le bleu Guimet a une
place de choix.
C'est un aluminosilicate de synthèse Na7(AlSiO4)6S3
fabriqué en 1826 par le chimiste et industriel français Jean-Baptiste Guimet
(1795 – 1871) à partir de kaolin (silicate d'aluminium), de carbonate de
calcium, de soufre, de sulfate de sodium et de charbon de bois.
C'est
en recherchant un substitut moins coûteux au pigment bleu outremer utilisé en peinture d'art
et jusque là obtenu en broyant une roche métamorphique, le lapis-lazuli, que
Guimet mit au point ce bleu qui porte désormais son nom.
Il a aussi servi à l'azurage de la pâte à papier (de nos jours ce
procédé n'a plus cours et on peut enlever la couleur essentiellement en
incorporant un composé fluorescent (DAS2) ou par blanchiment chimique).
Avant ce pigment plusieurs substances ont été employées pour
blanchir les fibres naturelles :
- Le smalt
Silicate de potassium et de cobalt préparé à partir de différents
sels de cobalt grillés avec du sable en présence d'air.
Sa couleur proche du bleu outremer a fait de lui un substitut au
coûteux pigment pour la coloration des vitraux, des céramiques et des
porcelaines, jusqu'au XIXème siècle où il est remplacé par les bleus de cobalt.
- L'orseille
(voir annexe 1)
couleur : bleu violet
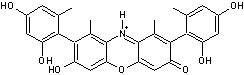
Cette molécule existe dans certains lichens (lichens dits à
orseille, par exemple Roccella phycopsis).
- L'indigo
Matière
colorante, qui dans sa forme première est d'un bleu un peu violacé (L'indigo absorbe
dans le jaune orangé (λmax d'absorption : 600
nm)).
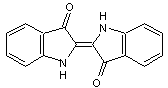
Elle
est extraite notamment de l'indigotier (Indigofera suffruticosa ou
indigofera anil) plante vivace des régions chaudes (Salvador...) de la
famille des papilionacées, ou du pastel (Isatis tinctoria) de la
famille des crucifères, autrefois cultivés comme plantes tinctoriales ; mais il
est aujourd'hui obtenu par synthèse (voir annexe 2).
- Le bleu de Prusse
C'est un hexacyanoferrate (II) de fer
(III)
Fe4III[FeII(CN)6]3.15H2O

Ce complexe adopte un système
cristallin cubique à faces centrées, à structure lacunaire. Il peut s'y
introduire des ions alcalins, par exemple K+ et donner
KFeIII[FeII(CN)6].3H2O.
Le
bleu de Prusse absorbe dans le rouge lointain (λmax
d'absorption : 730 nm)
Il a été préparé pour la première fois à Berlin (on l'appelle
aussi pour cela le bleu berlinois) par l'artiste peintre Heinrich Diesbach, en
1710.
3-2) Fluorescence dans le bleu :
La deuxième façon de reconstituer le spectre de la lumière blanche
amputé de sa partie bleue absorbée par les fibres, est de fixer sur celles-ci
une molécule qui lorsqu'elle sera excitée par les UV présents dans la lumière
du jour, donnera lieu à une fluorescence qui produira de la lumière bleue
(c'est ce qu'on appelle un fluorophore ou fluorochrome).
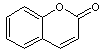
ont cette propriété ; par exemple le Pacific blue ® ou
3-carboxy-6,8-difluoro-7-hydroxycoumarine
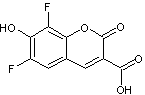
est un composé fortement fluorescent utilisé en biologie
cellulaire.
Excité à 401 nm il émet une lumière de longueur d'onde 455 nm.
Le premier agent azurant qui a été utilisé industriellement est la 4-méthylumbelliférone ou coumarine 4
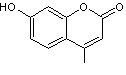
qui émet dans le bleu en milieu basique (Excitation dans un tampon
pH = 10,2 : λ = 365 nm
; émission à λ = 445
nm).
La 4-méthylumbelliférone est également un standard pour la
détermination fluorimétrique de l'activité d'une enzyme.
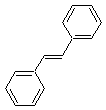
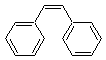
Le stilbène ou 1,2-diphényléthène existe sous deux formes
diastéréoisomères :
|
Le (E)-stilbène
|
Le
(Z)-stilbène
|
Seuls les dérivés du (E)-stilbène excités par des UV sont
fluorescents.
Trois molécules correspondent à l'essentiel des azurants
industriels utilisés dans les lessives et pour le blanchiment des papiers et
des matières plastiques :
DSBP, DAS1 et DAS2.
Ces molécules possèdent des groupes sulfonate qui permettent aux
azurants de se fixer facilement sur la cellulose constituant des fibres
naturelles et des papiers.
- DSBP
(DiStyrylBiPhényle)
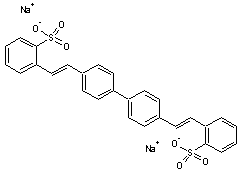
dont le nom complet est 4,4'-bis(2-sulfostyryl)biphényle de
disodium, est un solide cristallisé de couleur jaune. Il y a deux molécules de
stilbène liées ; à noter que seul l'isomère (E)-(E) est fluorescent.
Deux pics de fluorescence apparaissent :
1- Excitation à λ = 350 nm
et émission correspondante à λ = 436 nm
2- Excitation à λ =
235-265 nm et émission correspondante à λ = 435 - 445 nm
Il est principalement incorporé aux lessives et aux détergents.
Cette molécule est rapidement dégradée par la lumière ; il se
produit une oxydation rapide des doubles liaisons éthyléniques en donnant
plusieurs aldéhydes dont par exemple le 2-sulfonate benzaldéhyde de sodium
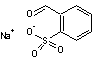
et le 4-formyl-4'-(2-sulfostyryl) biphényle
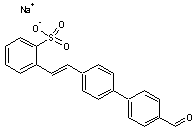
Les deux autres molécules DAS1 et DAS2 sont des diaminostilbènes :
- DAS1
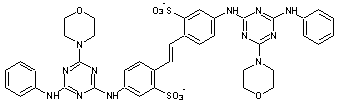
Son nom complet :
4,4'-bis
[(4-anilino-6-morpholino-1,3,5-triazin-2-yl)amino]stilbène-2,2'-disulfonate.
Des pics de fluorescence :
1- Excitation à λ = 335-355 nm et émission correspondante à
λ = 430-449 nm
2- Excitation à λ = 240-250 nm et émission correspondante à
λ = 433-446 nm
Il est comme le DSBP, principalement incorporé aux lessives et aux
détergents.
Cette molécule est aussi rapidement détruite par la lumière
naturelle, mais moins rapidement que le DSBP.
- DAS2
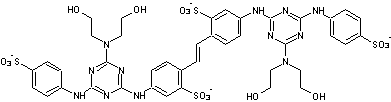
C'est le
4,4'-bis[4-(4-sulfoanilino)-6-bis((2-hydroxyéthyl)amino-1,3,5-triazin-2-yl)amino]stilbène-2,2'-disulfonate.
Sa fluorescence est comparable à celle du DAS1.
Utilisé essentiellement pour blanchir les papiers.
Remarque : Les papiers utilisés pour fabriquer des billets de banque ne
doivent pas contenir d'azurant. Un des moyens utilisé pour détecter un faux
billet consiste à le soumettre à des rayons UV ; s'il est faux on voit
apparaître la fluorescence du papier blanchi avec lequel il a été fabriqué.
Comme le DAS1 cette molécule est rapidement détruite par la
lumière naturelle.
Le blanchiment consiste à enlever des taches dues à des substances
colorantes, par réaction chimique.
Le plus souvent on procède par action d'un oxydant assez puissant
qui détruit ou modifie le groupe chromophore du colorant (voir annexe 5) et qui transforme parfois les groupes auxochromes
qui l'accompagnent (voir annexe 3).
Ceux dont les effets sont les plus connus sont :
- L'eau
de Javel ; c'est l'ion hypochlorite ClO- qu'il contient qui
est l'élément oxydant. A pH = 14 son potentiel d'oxydation E0 (ClO-/Cl-)
vaut 0,88V :
ClO- + 2H+ +2e- = Cl- + H2O
Son action sur les textiles est assez agressive.
- Le peroxyde d'hydrogène ou eau oxygénée H2O2
dont le potentiel d'oxydation en milieu acide (pH =0) E0 (H2O2/H2O)
vaut 1,81V :
H2O2 + 2H+ + 2 e- = H2O
Son action blanchissante ne se fait sentir pour le linge qu'à
partir de 60°C.
C'est un solide cristallisé de formule 2Na2CO3.3H2O2
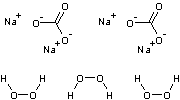
Il libère du peroxyde d'hydrogène en se dissolvant dans l'eau et
possède donc les propriétés oxydantes de celui-ci. Les ions carbonates rendent
le milieu basique.
C'est un solide blanc cristallisé de formule NaBO3
quand il est anhydre ; il est très instable et on lui préfère la forme
monohydratée NaBO3.H2O (ou NaBO2(OH)2)
dont la structure dimérisée est
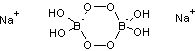
Il a très longtemps été utilisé dans les lessives ; comme le
percarbonate de sodium, il libère du peroxyde d'hydrogène qui réagit sur un des
composants de la lessive, la tétraacétyléthylènediamine (TAED) pour libérer de
l'acide peracétique. L'action blanchissante a lieu a plus basse température
qu'avec l'eau oxygénée.
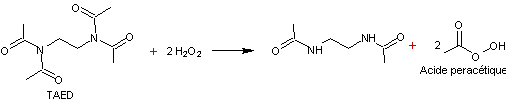
Il est de plus en plus abandonné en faveur du percarbonate, car la
libération de composés borés pose des problèmes environnementaux.
5) Le blanchiment photochimique :
Un textile coloré exposé fréquemment et de manière prolongée au
soleil ou à une forte luminosité, finit par voir ses couleurs s'estomper et
même disparaître.
Le phénomène est le même que pour le blanchiment chimique, à
savoir une modification du groupe chromophore des colorants et parfois
transformation des groupes auxochromes qui les accompagnent, mais qui s'opèrent
sous l'action de l'énergie des photons reçus, qui permet, en effet, la rupture
de certaines liaisons covalentes (voir annexe 4).
Réactions colorées de l'orseille
Suivant le pH l'orseille prend différentes couleurs :
Par pH décroissant
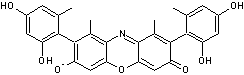
Couleur bleu violet
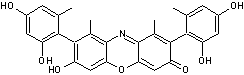
Couleur rouge violacé
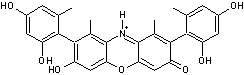
Couleur rouge
L'indigo :
Matière colorante, qui dans sa forme première est d'un bleu
un peu violacé. Elle est extraite notamment de l'indigotier (Indigofera
suffruticosa ou indigofera anil) plante vivace des régions chaudes
(Salvador...) autrefois cultivée comme plante tinctoriale, de la famille des
papilionacées, mais elle est aujourd'hui obtenue par synthèse.
L'indican (dérivé de l'indole) est la molécule première
existant dans les feuilles. L'hydrolyse enzymatique suivie d'une oxydation à
l'air conduit à la molécule d'indigo, ainsi que le montre le chemin de
réactions ci-dessous. Cette matière colorante a été pendant des siècles
utilisée comme teinture ; On obtenait 100g d'indigo en traitant 50kg de
feuilles.
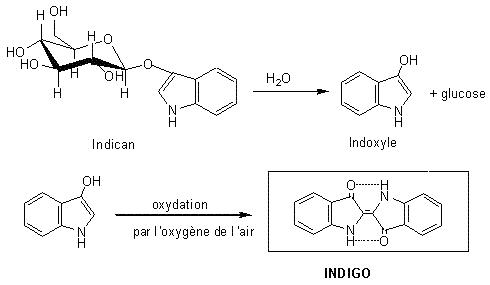
Cette molécule s'avéra très difficile à synthétiser ; A.Baeyer mit dix ans pour en établir
la constitution puis la synthétiser. C'est le procédé de Karl Heumann qui fut
adopté pour la synthèse industrielle à grande échelle. C'est à partir de 1897
que l'indigo artificiel remplaça l'indigo naturel.
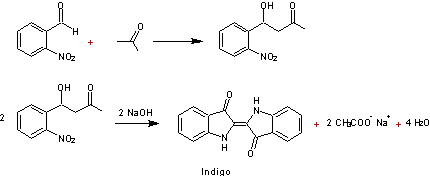
Synthèse de l'indigo
Crotonisation du 2-nitrobenzaldéhyde et de la propanone (Synthèse de
Baeyer-Drewsen)
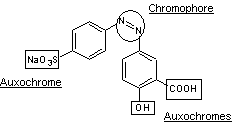
Chromophore et auxochromes
Dans l'exemple suivant d'un
colorant azoïque, les groupes chromophore et auxochromes sont repérés :
Dégradation d'un colorant
azoïque par exposition à la lumière :
On trouve dans la littérature un mécanisme probable de dégradation
des colorants azoïques par substitution du radical HO. (Hydroxyl
radical mediated degradation of azo dyes : evidence for benzene degradation. Environ.
Sci. Technol. 28 1389-1393 Spadaro,J.T., Isabelle,L. and
Renganathan, V. (1994) ) :

On peut légitimement penser que c'est un tel mécanisme qui
intervient lorsqu'un textile coloré est exposé au soleil ou même seulement à la
lumière du jour d'une façon prolongée, la lumière et l'humidité permanente de
l'air conduisant à la réaction :
![]()
Destruction du groupe azo d'un colorant azoïque par un oxydant
comme le peroxyde d'hydrogène :
Prenons comme exemple de colorant azoïque, le 4-(phénylazo)phénol
:
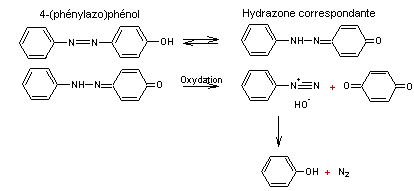
Remarque :
Ce mécanisme de destruction d'un colorant hydroxyazoïque comme le
4-(phénylazo)phénol ne s'applique pas aux aminoazoïques qui ne donnent pas
d'hydrazone.