STEREOCHIMIE
DES MOLECULES ORGANIQUES
Plan de la
leçon :
1) définition
de l'isomérie
2) différents
types de représentation des molécules
3) isomères de constitution
4) stéréo-isomérie
Deux
molécules sont isomères si elles ont même formule moléculaire mais des formules
développées différentes.
On distinguera:
- des isomères de constitution : une représentation développée plane
permettra de les différencier
- des stéréo-isomères:
il faudra une représentation développée dans l'espace pour les
représenter.
2) Différents types de représentation des molécules :
2-1)
Représentations planes :
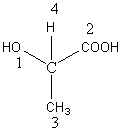
a) formules semi-développées :
Les hydrogènes sont regroupés autour des carbones formant le squelette de la molécule.Seules les fonctions sont développées.
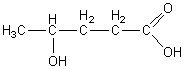
Exemple: Acide 4-hydroxypentanoïque.
b) formules topologiques :
Ce type de formule , trés utilisé en biochimie, pour représenter les grosses molécules (substances naturelles) est une représentation trés simplifiée de la molécule :
- La chaîne
carbonée est disposée en zigzag ; c'est une ligne brisée qui peut comporter des
ramifications ; ni les atomes de carbone, ni les atomes d'hydrogène qui leur
sont liés ne sont représentés. Les liaisons multiples sont mentionnées.
- Les atomes autres que C et H figurent par leur symbole,
ainsi que les atomes d'hydrogène qu'ils portent éventuellement.
Exemples :
Le butane ![]()
Le (E)
But-2-ène 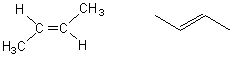
La
propanone 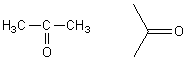
La vitamine
A 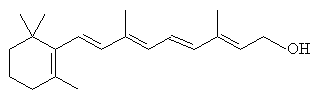
2-2) Représentations dans l'espace:
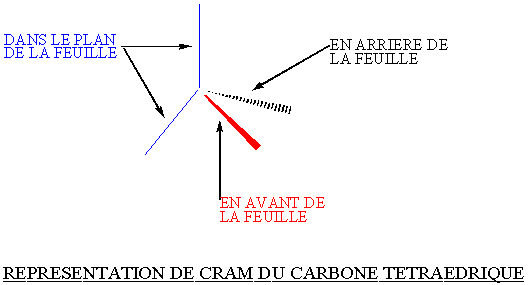
a) représentation de CRAM :permet de faire apparaître la structure
tétraédrique du carbone (l'atome de carbone occupe le centre et ses quatre
liaisons pointent vers les sommets d'un tétraèdre).
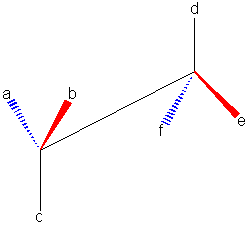
b) représentation en perspective:
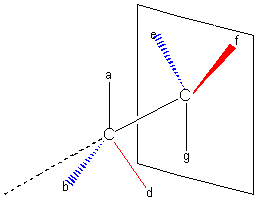
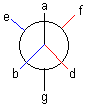
c) représentation (ou projection) de NEWMAN:
L' observateur vise le long d'une
liaison C-C et projette sur un plan perpendiculaire à l'axe de la liaison, ce
qu'il voit.
3) Isomères de
constitution : une représentation plane permet de les distinguer.
3-1) Isomérie de chaîne:
![]()
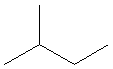 Chaîne ramifiée
Chaîne ramifiée
ou Isomérie de position d'une fonction dans la chaîne:
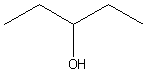 (OH sur
le carbone n° 3)
(OH sur
le carbone n° 3)
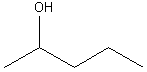 (OH sur
le carbone n° 2)
(OH sur
le carbone n° 2)
3-2) Isomérie de fonction:
 (Alcool)
(Alcool)
![]() (Ether-oxyde)
(Ether-oxyde)
4) Stéréoisomérie : une représentation dans l'espace est nécessaire pour les distinguer : On utilise la représentation de Cram pour représenter le carbone tétraédrique.
4-1)Stéréo-isomères de configuration: Les isomères peuvent être séparés
a) énantiomérie :
Une molécule ayant un carbone
asymétrique (les quatre liaisons aboutissent à 4 groupements différents
; un tel carbone est aussi appelé stéréocentre) possède une activité
optique c'est-à-dire qu'il a une action sur la lumière polarisée
(voir ci-aprés).
L' image d'une telle molécule dans un miroir (image spéculaire), ne lui est pas
superposable:
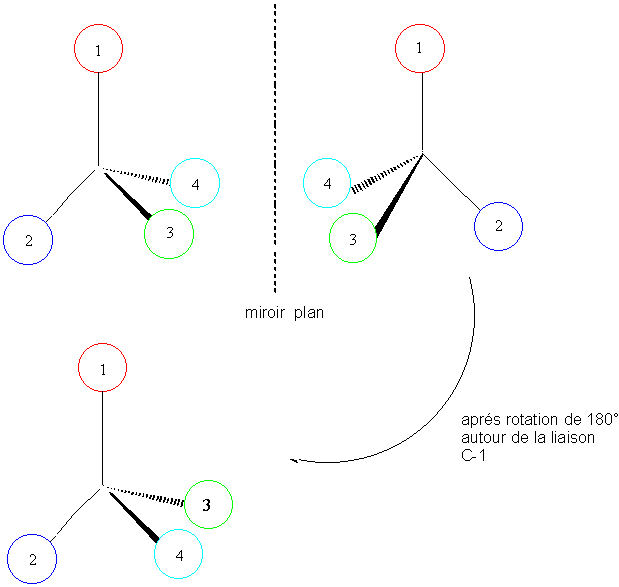
Exemple: acide
lactique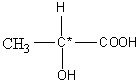
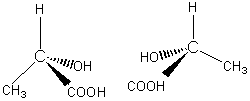
Ces molécules sont de ce
fait dites chirales ; elles sont des énantiomères.
L'un des énantiomères fait tourner le plan de polarisation (d'une lumière
polarisée) vers la droite (pour un observateur recevant le rayon lumineux), il
est dit dextrogyre ou (+), l'autre le fait tourner d'un même angle vers la
gauche il est dit lévogyre ou (-).
Pour distinguer les deux molécules, il faut déterminer leur configuration absolue en utilisant par exemple la notation de Cahn-Ingold et Prelog (prix Nobel 1975).
- Classement des substituants d'un carbone asymétrique :
On donne un
numéro à chaque atome directement lié à un carbone asymétrique, 1 étant prioritaire
par rapport à 2 et ainsi de suite. On attribue le numéro 1 à l'atome ayant le
plus grand Z (numéro atomique) ; ainsi dans le cas de l'acide lactique c'est
l'oxygène du OH qui aura le numéro 1.
Si deux atomes sont identiques (C de
CH3 et de COOH dans
l'acide lactique) on compare les atomes portés par ces deux atomes ; celui
portant un atome de Z supérieur aura priorité (ici le numéro 2 sera donné au C
de COOH car il porte un O alors que l'autre (CH3)ne porte que des H ).
Si l'indétermination subsiste, on
continue...ainsi un COOH aura prioritépar rapport à un CH2OH.
En cas de double ou de triple liaison on remplace formellement celles-ci par
deux ou trois liaisons simples.
Dans le cas de l'acide lactique on aura donc:
- Examen de la molécule afin de lui attribuer la configuration R ou S :
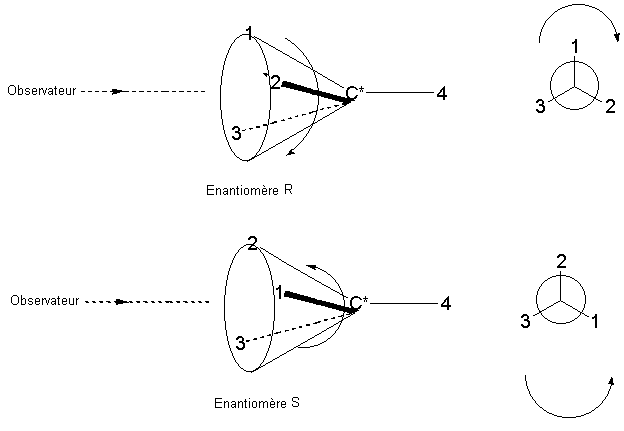
Remarque
: Il n'y a aucune relation entre la configuration R
ou S et le signe du pouvoir rotatoire de l'énantiomère, c'est-à-dire le
fait qu'il soit dextrogyre ou lévogyre ; autrement dit il existe des molécules
R qui sont dextrogyres, et d'autres qui sont lévogyres.
- Cas d'une molécule ayant plus d'un carbone asymétrique :
Lorsqu'une molécule possède deux stéréocentres, chacun d'eux
peut se trouver dans la configuration R ou dans la configuration S ; de sorte
que l'on peut trouver 4 stéréoisomères : RR, RS, SR, SS.
RR et SS constituent un couple d'énantiomères; et de même pour les
couples RS et SR. RR et RS ainsi que SR et SS sont des diastéréoisomères.
Remarque: des molécules
possédant plusieurs stéréocentres seront énantiomères, si elles ont des
configurations contraires à chaque stéréocentre.
exemple1 : 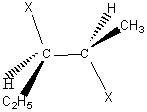 Cette molécule a
deux carbones asymétriques de configuration 2R 3R.
Cette molécule a
deux carbones asymétriques de configuration 2R 3R.
exemple2 : 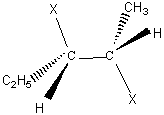 Cette molécule a
deux carbones asymétriques de configuration 2S 3S
Cette molécule a
deux carbones asymétriques de configuration 2S 3S
Ces deux molécules sont des
énantiomères.
b)diastéréo-isomérie :
Deux molécules, stéréoisomères, c'est-à-dire isomères géométriques, qui
ne sont pas des énantiomères sont des diastéréoisomères;
* Nous citerons les isomères de molécules ayant deux carbones asymétriques de configuration absolue RR SR, SS SR, RR RS, SS RS.
Remarque: des molécules possédant deux stéréocentres seront diastéréo-isomères, si elles ont même configuration sur l'un de ces carbones asymétriques et une configuration différente sur l'autre.
exemple :

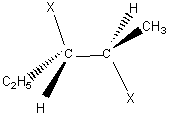
2R
3R
2R 3S
Ces deux molécules sont des diastéréoismères.
* C'est aussi le cas de l'isomérie Z/E (ou cis/trans)
Z-BUT-2-ENE  E-BUT-2-ENE
E-BUT-2-ENE![]()
c)propriétés des énantiomères et des diastéréo-isomères :
* propriétés physiques:
La plupart des propriétés physiques des énantiomères sont identiques (une exception pour l'action sur la lumière polarisée).
La plupart des propriétés physiques des diastéréo-isomères sont différentes : point de fusion, point d'ébullition, indice de réfraction....
On met à profit cela pour séparer les énantiomères, lorsqu'une synthèse, conduit à un mélange de ces deux isomères (voir plus loin).
* action sur la lumière polarisée:
La
loi de Biot régit, l'action
d'une substance active sur la lumière polarisée (rotation du plan de
polarisation), lorsque cette substance est dissoute dans solvant inactif :
a = [a]lt .l.r
avec
a angle de rotation en degrés l
longueur de solution traversée en dm.
r concentration en masse de la solution en g.cm-3
[a]lt pouvoir
rotatoire spécifique en °.dm-1.g-1.cm-3 c'est
lui qui dépend de la substance active.
remarque:les unités employées ne sont pas les unités S.I. ce sont des
unités usuelles.
Deux énantiomères possèdent
des pouvoirs rotatoires spécifiques opposés.
Un mélange équimolaire de deux énantiomères est inactif sur la lumière
polarisée, on l'appelle racémique.
Des diastéréoisomères possédant deux stéréocentres à substituants identiques (exemple CH3-CHX-CHX-CH3 ) et de configuration R S et S R sont identiques. Ils ne constituent donc plus qu'un seul isomère, et, celui-ci est inactif sur la lumière polarisée;on dira qu' il s'agit d'un composé méso.
d) séparation des énantiomères:
* Pourquoi vouloir les séparer?
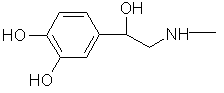
L'adrénaline lévogyre (-), est utilisée à des fins médicales.
Son isomère dextrogyre (+) est toxique ; d'où nécessité de les séparer lorsque
la synthèse de la molécule conduit à un mélange des deux énantiomères.
*Principe :
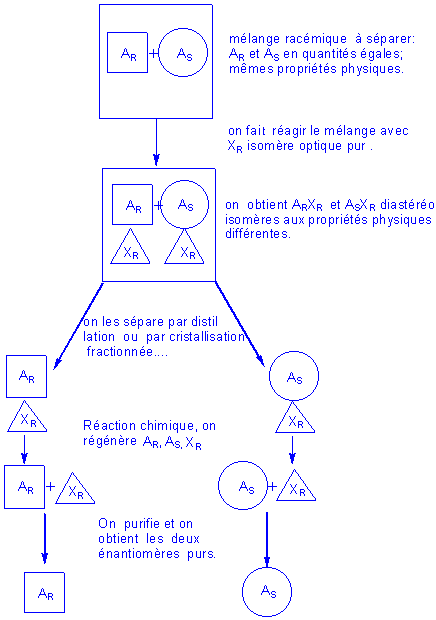
* Exemple
: On peut par exemple séparer les énantiomères de l'acide lactique racémique CH3-CHOH-COOH en utilisant la
phényléthanamine C6H5-CH(NH2)-CH3 de configuration S. Une réaction acido-basique
conduit à deux sels d'ammonium diastéréo-isomères que l'on peut séparer
facilement par cristallisation fractionnée ; par hydrolyse acide, on peut
ensuite récupérer les énantiomères de l'acide lactique et régénérer l'amine qui
pourra être réutilisée.
* Rappel historique : Pasteur, en 1850, tria manuellement les cristaux d'un sel de l'acide tartrique ( acide 2,3 dihydroxybutanedioïque COOH-CHOH-CHOH-COOH), en remarquant qu'il y avait deux groupes de cristaux, dont l'un était l'image spéculaire de l'autre.Il s'agissait de deux énantiomères.
4-2) Stéréoisomérie de conformation :
Les isomères (conformères) ne peuvent être
séparés. La libre rotation autour d'une liaison C-C, permet à la molécule de se
présenter avec des positions relatives différentes, pour les carbones situés de
part et d'autre de cette liaison.
Si l'on envisage l'énergie potentielle de cette molécule, on s'aperçoit qu'elle
varie suivant la position respective des hydrogènes des deux carbones
adjacents.Il existe deux positions extrêmes, d' un point de vue énergétique :
l'éthane éclipsée, la moins stable (énergie potentielle maximale) et l'éthane
décalée, la plus stable (énergie potentielle minimale).Entre ces deux positions
l'énergie varie comme le montre la courbe ci-dessous.
La barrière d'énergie à franchir pour passer de l'une à l'autre est faible
(12,5kJ) ce qui explique que les molécules tournent relativement librement
autour de la liaison C-C.
ETHANE ECLIPSE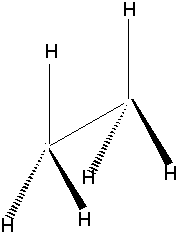
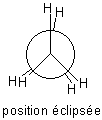
ETHANE DECALE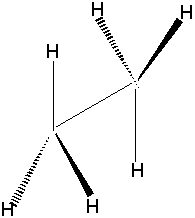
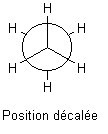
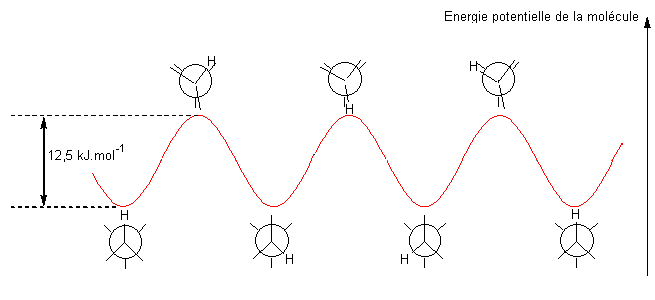
La barrière d'énergie qui doit être franchie trois fois au cours d'une rotation
complète de la molécule pour passer de la conformation décalée (la plus stable,
énergie minimale) à la conformation éclipsée (la moins stable, énergie
maximale) est de 12,5 kJ/mol.
Si l'on remplace un H par un CH3- sur l'un des carbones on s'aperçoit que
la barrière d'énergie passe à 14,2kJ.mol-1,
ce qui s'explique par une répulsion plus forte, entre un H de l'un des carbones
et le CH3- que porte l'autre,
en position éclipsée, du fait de l'encombrement stérique plus important du CH3- .
On comprend alors, pourquoi, dans le cas des alcanes à chaîne plus longue (voir
cas du butane ci-dessous) on a une chaîne en zig-zag;deux liaisons C-Hde deux
carbones adjacents sont ainsi systématiquement en position décalée.
BUTANE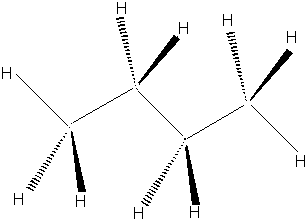
CAS DU CYCLOHEXANE
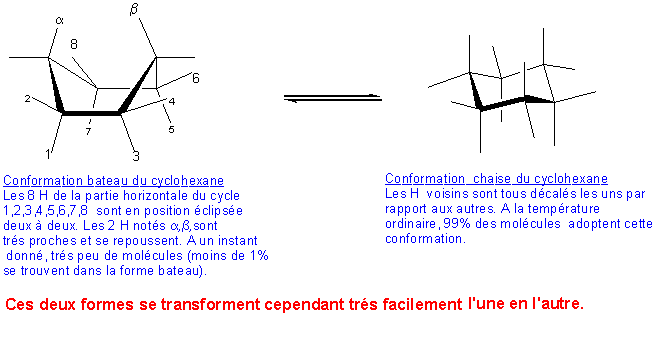
Remarque1 : les tensions
dues aux gênes stériques des H en a et b dans le cyclohexane bateau (tensions
transannulaires) sont diminuées par torsion du cycle (voir ci-dessous);
cette nouvelle conformation appelée" twist" par les anglo-saxons est
la conformation bateau flexible.
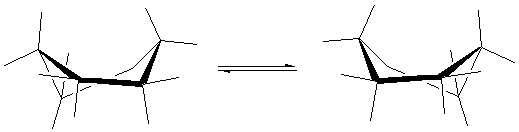
Remarque 2 :
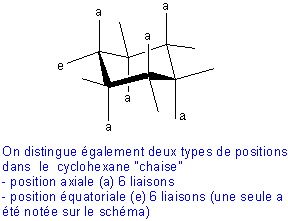
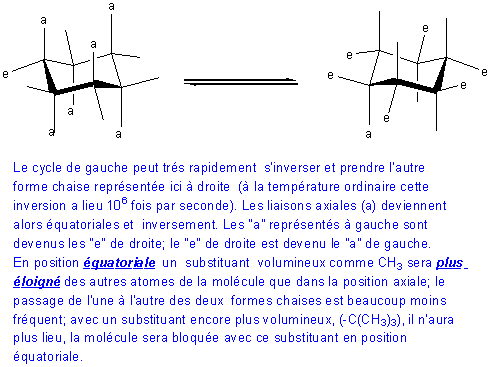
Cas des cyclohexanes
disubstitués:
- cyclohexanes disubstitués1,1 : les deux conformations sont énergétiquement identiques ;elles ont la même stabilité.
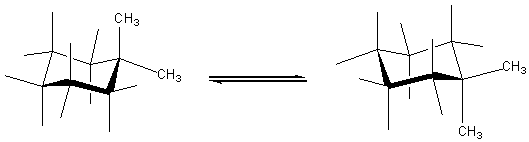
- cyclohexanes disubstitués1,2 1,3 ou 1,4 :
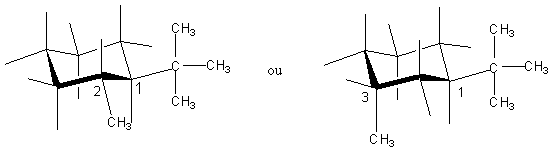
Ce sont les formes chaises où les substituants sont:
- tous les deux équatoriaux (voir exemple ci-dessus à gauche)
- ou bien le plus encombrant en position équatoriale
qui sont les plus stables.