LE BENZENE
1) Les différentes
formules :
2) propriétés physiques
3) propriétés chimiques
Combustions, oxydations, additions, substitutions
électrophiles
4) résumé :
1) Les
différentes formules :
1-1) Formule
moléculaire : C6H6
1-2) Formule
topologique :
On peut adopter la représentation de Kékulé:
Cette représentation est commode pour montrer les
mécanismes réactionnels.
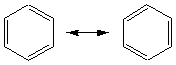
Il n'est pas possible d'isoler ces deux formes
(mésomérie): l'équilibre n'existe pas, on ne peut considérer qu'une double
liaison existe entre deux carbones adjacents.
L'énergie de résonance (entre le benzène et un
hypothétique cyclohexatriène à doubles liaisons figées) qui renseigne sur la
stabilité de la molécule, est élevée (environ 150kJ/mol-1).
1-3) Représentation 3D :
Compacte
Eclatée
1-4) Structure :
Molécule plane,
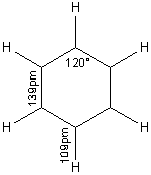
les 6 carbones sont en état d'hybridation sp2
(angles de 120°) avec recouvrement latéral des orbitales non hybrides 2pz:
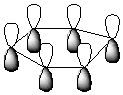
Les électrons non appariés sont délocalisés sur
l'ensemble des 6 atomes de carbone du cycle ; les molécules possédant ce cycle
sont des molécules à noyau benzénique; on dit qu'elles sont aromatiques.
2)Propriétés Physiques:
Masse molaire
: 78,12
g.mol-1
T d'ébullition:
80,1°C
T de fusion:
5,5°C
Densité:
0,8765 20/4
Indice de réfraction: 1,5011 20
Solubilité:
éthanol,acétone,éther,acide acétique
Risque:
Facilement inflammable et Toxique (R : 45-11-48/23/24/25 S: 53-16-29-44)
3-1)Combustion
dans l'air et dans l'oxygène :
- Dans
l'air :
combustion très incomplète (flamme très fuligineuse)
- Dans le
dioxygène :
![]()
Ce fort dégagement de chaleur pourrait faire du
benzène un excellent combustible, on ne l'utilise pas à cause de sa toxicité.
3-2)Oxydation par
le dioxygène :
-

on aboutit au benzophénol.
- Dans
d'autres conditions :
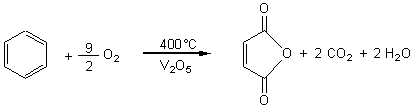
on obtient l'anhydride maléique.
3-3)Additions:
- H2:
Il y a addition de 3 molécules de dihydrogène en une
seule fois on obtient le cyclohexane C6H12.
-Cl2:

Cette réaction a lieu sous l'action des
ultra-violets, à la température ordinaire ; le benzène se sature en une seule
fois, on obtient le 1,2,3,4,5,6-hexachlorocyclohexane (anciennement utilisé
comme insecticide sous l'appellation commerciale HCH).
Ces réactions d'addition sont beaucoup plus
difficiles à réaliser qu'avec les alcènes et les alcynes.
3-4)Substitutions
électrophiles :
c'est l'essentiel des propriétés chimiques du
benzène.
3-4-1) Mécanisme :
C'est l'intermédiaire de Wheland;
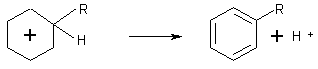
bilan :

3-4-2)
Halogénation :
*le dérivé iodé est donné par action de ICl (I+
+ Cl-)
*Dichlore
et dibrome même moyen d'action:
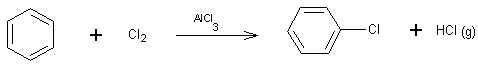
AlCl3 acide de Lewis permet la
formation de l'agent électrophile Cl+
3-4-3) Nitration :
agent électrophile NO2+ (formé
par réaction de H2SO4 sur HNO3 mais présent
aussi dans HNO3 concentré)

Qui se décompose donc en :
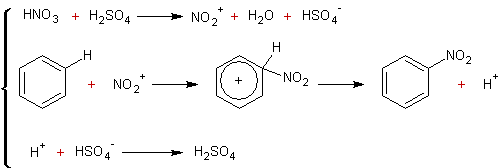
3-4-4) Sulfonation :
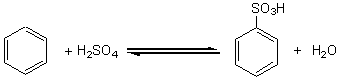
3-4-5) Réaction
de Friedel et Crafts :
*
alkylation:
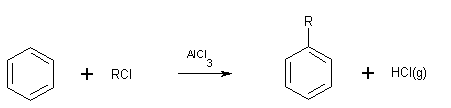
l 'agent électrophile est R+ mais ce
carbocation est susceptible de réarrangement interne
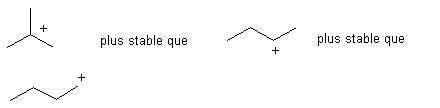
On obtient donc plusieurs isomères et en particulier
les plus ramifiés.
*acylation:
il s'agit de la fixation d'un groupement acyle R-CO-
sur le noyau benzénique.
Exemple:
Avec un chlorure d'acyle :
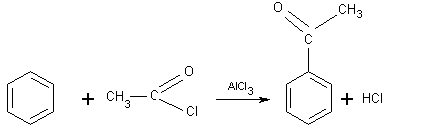
C'est
l'ion acylium R-C(+)=O qui est le réactif électrophile.
Autre exemple
:
Avec un anhydride d'acide :
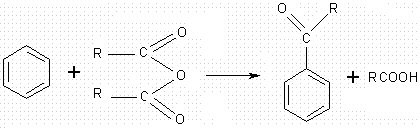
3-4-6) Polysubstitutions ; règles de Hollemann :
Le premier substituant d'un noyau benzénique, influe sur la position d'un deuxième substituant. On classe les premiers groupements substituants en 3 catégories :
- Première catégorie: -R
-OH -OR -NH2
Ils
repoussent les électrons, enrichissent le noyau aromatique et favorisent (ou
activent) une deuxième Substitution Electrophile........ils orientent en ortho
ou en para :

- Deuxième catégorie
: -NO2, -CN , SO3H
,-COOH , -CHO, COOR
Ils attirent les électrons à eux, appauvrissent
le noyau aromatique et défavorisent (désactivent) une deuxième Substitution Electrophile........ils
orientent en méta.

- Troisième catégorie : les halogènes, ont un caractère défavorisant, donc désactivent une deuxième Substitution Electrophile, mais orientent en ortho ou para.
LE BENZENE
(fiche)
LE BENZENE (résumé)
