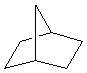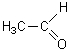LE DEGRE D'INSATURATION DES MOLECULES
1) Définition:
C'est la somme du nombre de liaisons p et du nombre de cycles d'une molécule.
Exemples:
|
Formule
brute |
Formule topologique |
Nom |
Degré d'insaturation |
|
C5H12 |
|
Pentane |
Degré d'insaturation |
|
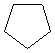
C5H10 |
|
Cyclopentane |
DI
= 1 |
|
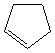
C5H8 |
|
Cyclopentène |
DI
= 2 |
|
C6H12 |
|
2-méthylpent-1-ène |
DI
= 1 |
|
C7H12 |
|
Norbornane |
DI
= 2 |
|
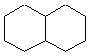
C10H18 |
|
Décaline |
DI
= 2 |
|
C2H6O |
|
Méthoxyméthane |
DI
= 0 |
|
C2H4O |
|
Ethanal |
DI
= 1 |
|
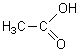
C2H4O2 |
|
Acide
éthanoïque |
DI
= 1 |
|
CH5N |
|
Méthanamine |
DI
= 0 |
|
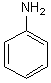
C6H7N |
|
Aniline |
DI
= 4 |
|
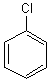
C6H5Cl |
|
Chlorobenzène |
DI
= 4 |
2) Intérêt de ce paramètre:
Déterminer le degré d'insaturation d'une molécule à
partir de sa formule semi-développée, développée ou topologique, ne présente
pas beaucoup d'intérêt. Par contre le déterminer à partir de sa formule moléculaire permet
d'obtenir un indice qui, associé à d'autres provenant des différentes méthodes
spectroscopiques (IR, RMN, Spectre de masse...) conduit à la détermination de
la structure de la molécule et donc à sa formule développée.
3) Détermination du degré d'insaturation à
partir de la formule brute:
C'est la comparaison entre le nombre d'hydrogènes qui existent dans la molécule
Heffectif et le nombre d'hydrogènes qui
existeraient dans l'hydrocarbure saturé ayant le même nombre de carbones Hsat qui permet d'obtenir le degré d'insaturation:
|
DI =(Hsat-Heffectif)/2 |
3-1) Exemples à partir d'hydrocarbures:
a) C5H12
Heffectif=12 Hsat :nC=5 nH=2nC+2
=12 Hsat=nH=12
DI =(Hsat-Heffectif)/2=(12-12)/2
= 0 C'est le cas du pentane.
b) C5H10
Heffectif=10 Hsat :nC=5 nH=2nC+2
=12 Hsat=nH=12
DI =(Hsat-Heffectif)/2=(12-10)/2
= 1 C'est le cas du cyclopentane.
c) C5H8
Heffectif=8 Hsat :nC=5 nH=2nC+2
=12 Hsat=nH=12
DI =(Hsat-Heffectif)/2=(12-8)/2
= 2 C'est le cas du cyclopentène.
d) C6H12
Heffectif=12 Hsat :nC=6 nH=2nC+2
=14 Hsat=nH=14
DI =(Hsat-Heffectif)/2=(14-12)/2
= 1 C'est le cas du 2-méthylpent-1-ène.
e) C7H12
Heffectif=12 Hsat :nC=7 nH=2nC+2
=16 Hsat=nH=16
DI =(Hsat-Heffectif)/2=(16-12)/2
= 2 C'est le cas du Norbornane.
f) C10H18
Heffectif=18 Hsat :nC=10 nH=2nC+2
=22 Hsat=nH=22
DI =(Hsat-Heffectif)/2=(22-18)/2
= 2 C'est le cas de la décaline.
3-2) Exemples à partir de
composés oxygénés (ou soufrés):
La façon de déterminer le degré d'insaturation
est le même que pour les hydrocarbures:
g) C2H6O
Heffectif=6
Hsat :nC=2 nH=2nC+2
=6 Hsat=nH=6
DI =(Hsat-Heffectif)/2=(6-6)/2
= 0 C'est le cas du méthoxyméthane.
h) C2H4O
Heffectif=4
Hsat :nC=2 nH=2nC+2
=6 Hsat=nH=6
DI =(Hsat-Heffectif)/2=(6-4)/2
= 1 C'est le cas de l'éthanal.
i) C2H4O2
Heffectif=4 Hsat :nC=2 nH=2nC+2
=6 Hsat=nH=6
DI =(Hsat-Heffectif)/2=(6-4)/2
= 1 C'est le cas de l'acide éthanoïque.
3-3) Exemples à partir de
composés azotés:
Si l' on applique à la méthanamine (CH3-NH2), la règle
appliquée aux hydrocarbures ou aux composés oxygénés, on trouve: Hsat=4 et Heffectif=5
soit DI =(Hsat-Heffectif)/2=(4-5)/2 = -0,5 ce qui n'a aucun sens (le vrai DI est 0
nous l'avons vu). De même pour l'aniline (C6H7N), on
trouve: Hsat=14 et Heffectif=7 soit DI =(Hsat-Heffectif)/2=(14-7)/2 = 3,5 le vrai DI étant égal à 4.
Il faut donc pour les composés azotés utiliser une
autre règle pour le calcul de Hsat :
|
Hsat = 2nC+2+nN |
et
procéder comme avec les autres composés:
Ainsi pour la méthanamine: Hsat=2x1+2+1=5
Heffectif=5 soit DI
=(Hsat-Heffectif)/2=(5-5)/2 = 0 On retrouve la bonne valeur. Et pour
l'aniline: Hsat=2x6+2+1=15
Heffectif=7 soit DI
=(Hsat-Heffectif)/2=(15-7)/2 = 4, c'est la bonne valeur.
Un autre exemple: le p.diaminobenzène
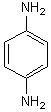 Formule moléculaire C6H8N2 dont le DI vaut 4 ( trois "liaisons p ", un cycle) : Hsat=
14 +2 = 16 Heffectif=8
soit DI =(Hsat-Heffectif)/2=(16-8)/2 = 4
Formule moléculaire C6H8N2 dont le DI vaut 4 ( trois "liaisons p ", un cycle) : Hsat=
14 +2 = 16 Heffectif=8
soit DI =(Hsat-Heffectif)/2=(16-8)/2 = 4
3-4) Exemples à partir de
composés halogénés:
Si l'on applique au chlorobenzène (C6H5Cl),
la règle appliquée aux hydrocarbures ou aux composés oxygénés, on trouve: Hsat=14 et Heffectif=5
soit DI =(Hsat-Heffectif)/2=(14-5)/2
= 4,5 alors que la vraie valeur est 4.
Il faut donc pour les composés halogénés utiliser une
autre règle pour le calcul de Hsat :
|
Hsat = 2nC+2-nX |
La détermination du DI, avec Hsat calculé selon cette formule
conduit bien à une valeur de 4:
Hsat=2x6+2-1=13 Heffectif=5 soit DI =(Hsat-Heffectif)/2=(13-5)/2 = 4.
3-5) Règle générale de
détermination du DI à partir de la formule moléculaire:
|
Hsat = 2nC+2+nN-nX |
puis
|
DI
= (Hsat -Heffectif)/2 |
Un exemple très général:
Détermination du degré d'insaturation
d' une molécule de formule moléculaire C22H24O8N2
Hsat = 2x22 +2 +2
= 48
Heffectif= 24
DI = (Hsat -Heffectif)/2
= (48-24)/2 = 12
Ce qui peut être vérifié sur la formule de la tétracycline qui correspond à
cette formule moléculaire:
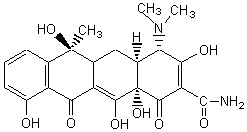
DI = 12 car on trouve 4 cycles et 8 liaisons p .
Autre exemple d'utilisation :
On souhaite établir la formule moléculaire d'une
molécule assez complexe, par exemple l'acide
chlorogénique :
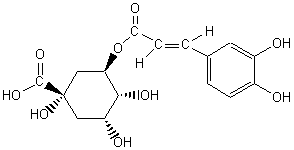
On compte les atomes de carbone et d'oxygène qui sont
faciles à dénombrer : 16C et 9O. On utilise le degré d'insaturation
qui est de 8 (6 doubles liaisons et 2 cycles) pour trouver le nombre d'H
effectifs :
DI =(Hsat-Heffectif)/2
soit Heffectif =
Hsat -2.DI = (2x16+2) - 2x8 = 18
La formule moléculaire de l'acide chlorogénique
est C16H18O9.