SPECTROMETRIE INFRAROUGE
1) Rappels - généralités
2) Etude des spectres I.R
2-1) domaine d'étude
2-2) un spectre IR
2-3) méthode d’étude d’un spectre IR
2-4) les principaux groupements fonctionnels
3) Quelques spectres IR
1) Rappels – Généralités :
La
spectrométrie IR est une spectrométrie d’absorption
. Elle met en jeu des énergies moins élevées que la spectrométrie UV-Visible
qui touche les électrons de la molécule. Elle concerne :
- les énergies de vibration des atomes : Ce sont les vibrations des atomes dans la molécule qui ont été modifiées. Ces énergies sont quantifiées.
- les énergies de rotation des molécules : Les énergies mises en jeu sont encore moins élevées, on est dans l'IR plus lointain. Ces énergies sont quantifiées.
- les énergies de translation des molécules: Les énergies sont encore plus petites. Ces énergies ne sont pas quantifiées. N'importe quel photon est susceptible de modifier l'énergie de translation d'une molécule.
Remarque: Seules les énergies quantifiées sont intéressantes en spectrométrie. L'étude du rayonnement transmis comparé au rayonnement incident, permet de connaître les énergies qui ont été fournies au milieu et par là, la structure de celui-ci.
2-1) Domaine d'étude: La spectrométrie IR, permet par interprétation des spectres obtenus, de déceler les groupements fonctionnels contenus dans une molécule: alcool, aldéhyde, cétone, acide..., ainsi que les liaisons entre les carbones d'une chaîne (chaîne saturée, insaturée, caractère aromatique d'une molécule)....
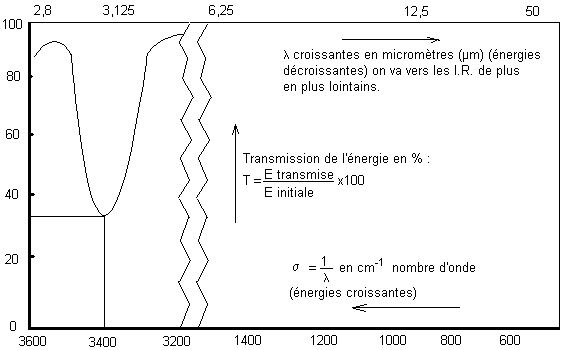
Lecture: Il y a
un "pic" d'absorption (un creux de transmission) vers 3400 cm-1.
* A 3600 cm-1ou à 3200 cm-1 toute l'énergie(100%) du rayonnement a été transmise.
* A 3400 cm-1 seulement 35% de l'énergie incidente a été transmise.
Remarque : Nous aurions pu porter en ordonnées, l'absorbance A de la solution et non la transmission. A = log(1/T). La courbe aurait alors été inversée.
2-3)Méthode d'étude d'un spectre I.R :
On utilise une table donnant les nombres d'ondes des vibrations de valence (vibrations se produisant le long des liaisons) ou de déformation des principales fonctions chimiques et l'on essaie:
- d'abord de repérer le ou les groupements fonctionnels de la molécule: alcool, aldéhyde, acide....
- puis d'autres détails: les carbones sp3 ou sp2, éventuellement aromatiques...
2-4) Les principaux groupements fonctionnels:
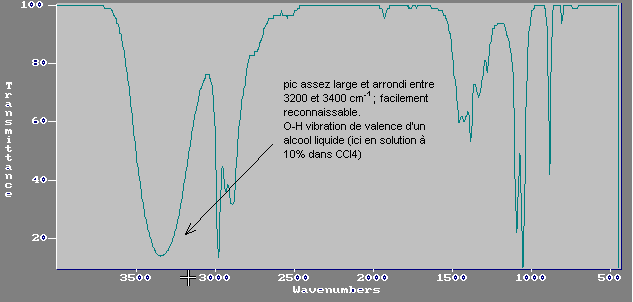
a) Les alcools: plusieurs cas:
* en phase vapeur (pas de liaison hydrogène) : pic vers
3600 cm-1
O-H (vibration de valence)
* en phase liquide (liaisons hydrogène): pic assez large et arrondi entre 3200 et 3400 cm-1.
O-H (vibration de valence)
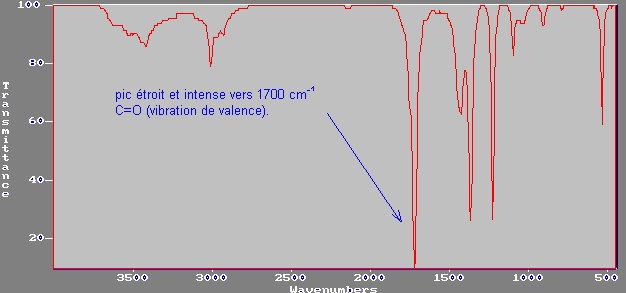
b) cétones:
C=O vibration de valence
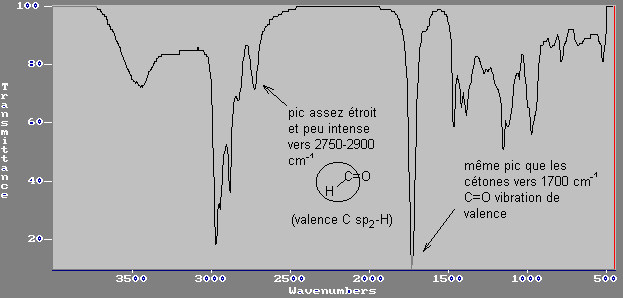
c) aldéhydes:
C=O vibration de valence
C(sp2)-H
vibration de valence
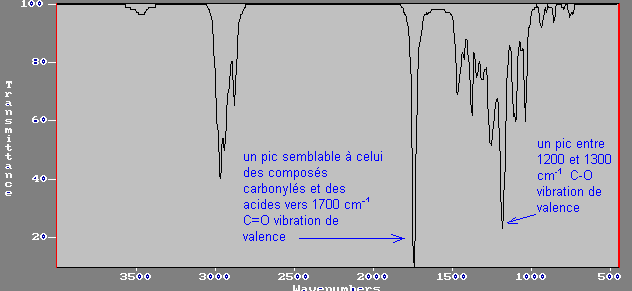
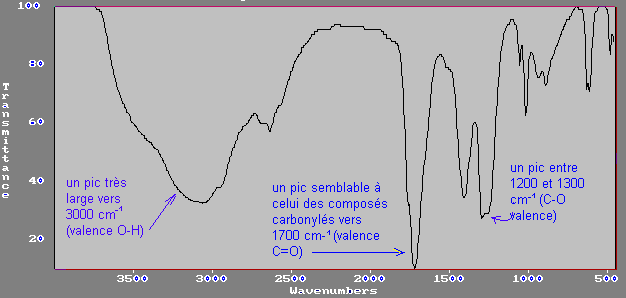
d) acides:
C=O vibration de valence
C-O
vibration de valence
O-H
vibration de valence
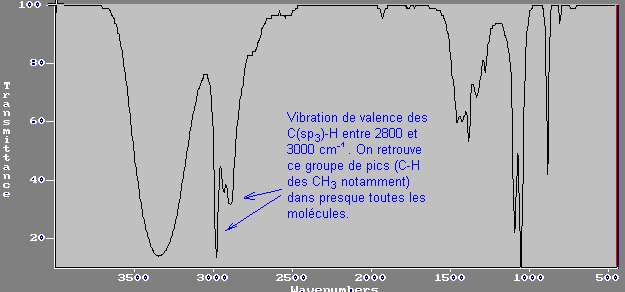
Remarque :Dans l'ensemble des spectres présentés précédemment, sauf dans
les acides (alcools, aldéhydes, cétones), nous avions un groupe de pics entre
2800 et 3000 cm-1. Il s'agissait de la vibration de valence des
liaisons Csp3-H de ces molécules. Souvent pour les acides
carboxyliques, ce groupe de pics est englobé dans le pic très large de
vibration du O-H et ne se distingue pas.
e) esters:
C=O vibration de valence
C-O
vibration de valence