PREPARATION DE LA BUTANONE
(CORRIGE DU COMPTE-RENDU)
RETOUR
AU SOMMAIRE
Compte-rendu:
3-1)
Equation et rendement:
-
Ecrire la réaction d'oxydation du butan-2-ol par le dichromate de
sodium en milieu acide sulfurique.
-
Calculer la masse théorique de butanone obtenue.
-
Calculer le rendement de la synthèse.
3-2)
Questions:
a) L'ordre dans lequel on vous demande de préparer le mélange
sulfochromique a-t-il une importance? Pourquoi?
b) Rôle du chlorure de sodium dans cette synthèse? Quel est
le nom de cette opération?
c) Quel matériel utiliser pour effectuer une rectification?
3-3)
Spectre
IR:
Mettre
en évidence les bandes correspondant aux vibrations de valence de
la liaison C=O.
Quelle
bande d'absorption très visible dans le spectre du butan-2-ol ne
se retrouve pas dans ce spectre de la butanone?
CORRIGE DU COMPTE-RENDU
3-1)Equation et rendement:
- Equations
d'oxydo-réduction:
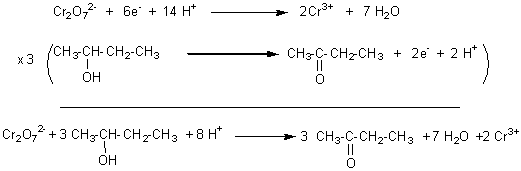
-
Masse théorique de butanone obtenue:
Tableau des réactifs:
|
Réactifs
|
Etat physique
|
Pureté
|
Densité
|
Masse molaire
(g.mol-1)
|
Masse ou volume utilisé
|
Quantité de matière
(mol)
|
|
Butan-2-ol
|
Liquide
|
100%
|
0,81
|
74
|
50mL
|
50x0,81/74=0,547
|
|
Na2Cr2O7,2H2O
|
Solide
|
100%
|
-
|
298
|
80g
|
80/298=0,268
|
|
H2SO4
|
Liquide
|
96%
|
1,83
|
98
|
80mL
|
80x1,83x96/(100x98)=1,434
|
Tableau d'avancement:
Dans le
tableau, les réactifs et les produits sont dans l'ordre de l'équation
chimique et c'est H2SO4
qui figure et non H+.
| |
x
|
|
|
|
|
|
|
|
début
|
0
|
0,268
|
0,547
|
1,434
|
0
|
0
|
0
|
|
fin
|
xmax
|
0,268-xmax
|
0,547-3xmax
|
1,434-4xmax
|
3xmax
|
7xmax
|
2xmax
|
Réactif
limitant la réaction:
1ère
hypothèse: C'est le butan-2-ol qui est réactif limitant
On
a alors 0,547-3xmax=0
soit xmax= 0,547/3
= 0, 182 mol
Conséquence:
Il
reste: 0,268 - 0,182 = 0,0857 mol de dichromate et
1,434 - 4x0,182 = 0,705 mol d'acide sulfurique. Ces quantités sont
positives ..L'hypothèse de départ est la bonne.
Le
réactif limitant est le butan-2-ol.
Masse
théorique:
Il
se formera théoriquement: 3 xmaxmol
de butanone soit 3x 0,182 = 0,547 mol.
Soit
une masse théorique de:
0,547x72
= 39,4g
- Rendement:
R(%)
= Masse obtenuex100/masse théorique
R(%)
=Masse obtenuex100/39,4
3-2) Questions sur le
mode opératoire:
a) On
dissout d'abord le dichromate de sodium dans l'eau, puis on ajoute avec
précautions l'acide sulfurique...Il faut verser l'acide dans l'eau
et non le contraire pour éviter les projections.
b)Le
chlorure de sodium sature le milieu aqueux et de ce fait diminue la solubilité
des composés organiques (ici, la butanone préparée).
On recueille donc le maximum de butanone en évitant ainsi qu'une
partie ne reste dissoute dans l'eau. C'est le
relargage.
c)Une
rectification est la distillation fractionnée
d'un mélange homogène liquide. On utilise le même montage
qu'une distillation simple en incorporant entre le ballon et la tête
de colonne, une colonne à distiller, dont le rôle est de séparer
les constituants du mélange qui ont des points d'ébullition
assez voisins.Dans la colonne à distiller a lieu une succession
de vaporisations et de condensations qui enrichit peu à peu la vapeur,
qui monte, en constituant le plus volatil. Au sommet de la colonne on obtient
ce constituant pur.
3-3)Spectre
IR:



