DETERMINATION DE L'INDICE D'IODE D'UNE HUILE
1) Définitions
- Intérêt de la détermination de cet indice.
Corps gras : Ce sont
des triesters du glycérol et d'acides
gras (acides aliphatiques à longues chaînes saturées ou non). Ils possèdent
pour la plupart une ou plusieurs doubles liaisons et ont donc la propriété de
donner des composés d'addition avec les halogènes. On les appelle aussi
triglycérides et les biomolécules correspondantes sont appelées lipides.
Indice d'iode : noté : Ii
correspond à la masse d'halogène exprimée en grammes, calculée en I2
fixé sur les doubles liaisons de 100g de corps gras.
Intérêt de la mesure de l'indice d'iode: Iipermet de déterminer
le degré d'insaturation d'un corps gras.
Remarque : Comme le diiode se fixe très
lentement sur les doubles liaisons, on utilise le chlorure d'iode (réactif de Wijs) qui réagit plus facilement. C'est la méthode de Wijs.
2) Principe de la méthode.
On introduit une quantité de réactif de Wijs en excès
avec une masse d'huile connue avec précision.
Ce réactif s'additionne quantitativement sur les insaturations
selon la réaction :
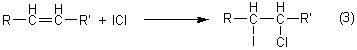
Le réactif de Wijs qui n'est pas fixé sur les doubles
liaisons est détruit lors de l'addition d'une solution d'iodure de potassium
pour former du diiode I2, selon la réaction :
I-Cl + I- = I2 + Cl-.
(4)
Le titrage du diiode formé, par une solution connue
de thiosulfate, permet de connaître la quantité de matière d'I-Cl.
Rappel :
![]() (5)
(5)
On réalise :
- le titrage d'un témoin
sans huile (ou titrage à blanc),
- le titrage après
réaction de l'échantillon.
Par
différence on détermine la quantité de diiode qui a
réagi.
Ce type de dosage est appelé titrage en retour ou indirect.
3) Mode opératoire et résultats.
Réactif de Wijs
: chlorure d'iode ICl en solution dans de l'acide
acétique pur (en réalité c'est une solution, dans l'acide acétique pur, de diiode et de trichlorure d'iode qui réagissent pour donner ICl selon l'équation I2 + ICl3
= 3ICl).DANGER. Manipuler sous la hotte, le port des gants et des
lunettes de protection est obligatoire.
Utiliser des flacons émeri ou des erlenmeyers à col
rodé.
- Flacon 1 : Introduire
10mL de tétrachlorure de carbone ( ou tétrachlorométhane) CCl4 et 10,0mL de
réactif de Wijs ; boucher.
- Flacons 2 et 3 : Peser
avec précision (balance au 1/10000 de g) 7 à 9 gouttes d'huile (arachide
ou olive) ; introduire 10,0mL de réactif de Wijs
et 10ml de tétrachlorométhane (ou tétrachlorure
de carbone) CCl4. Boucher, placer ces deux flacons à
l'obscurité environ 30 min et agiter de temps en temps.
Interpréter
la mise en solution dans le tétrachlorure de carbone, la mise à l'obscurité et
l'attente de 30 min.
Avant chaque titrage, introduire 50ml d'eau distillée et 15mL d'iodure de
potassium à 10%. Agiter à l'aide d'un agitateur magnétique durant 5min.
Doser dans tous les cas le diiode I2 libéré par le thiosulfate de
sodium.
a) Calculer la quantité de diiode
(nI2)0 présent dans le témoin T en fonction de CS2O32- et de (VS2O32-)T.
(4) montre que (nI2)0 = (nICl)
initialement introduit libre.
b) Calculer la quantité de diiode
(nI2)A ou B présente
dans les essais A et B en fonction de CS2O32- et de (VS2O32-)A ou B.
c) En déduire la relation donnant la quantité de diiode fixé : nI2 = (nI2)0
- (nI2)A ou B en fonction de CS2O32- et des volumes de
thiosulfate versés.
d) Calculer l'indice d'iode de l'huile étudiée.
Tableau récapitulatif :
|
|
Flacon
1 : témoin
T |
Flacon
2 : Essai
A |
Flacon
3 : Essai
B |
|
Masse
d'huile m (g) |
|
|
|
|
VS2O32-
(mL) |
|
|
|
|
Diiode dosé |
|
|
|
|
Diiode fixé nI2 |
|
|
|
|
Indice
d'iode : Ii |
|
|
|