ALDEHYDES
1) Formule générale
2) Formule brute
3) Nomenclature
4) Propriétés physiques
5) Propriétés chimiques
6) Préparations
7) Résumé
1)Formule générale :
R-CHO
(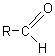 ) ou Ar-CHO (
) ou Ar-CHO ( )
)
groupement
fonctionnel : 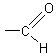 (carbone trigonal plan)
(carbone trigonal plan)
Remarque: le groupement C=O que l'on trouve aussi
dans les cétones, fait que l'on englobe ces 2 familles dans un ensemble appelé
composés carbonylés.
2)Formule brute :
(R-CHO
saturé): CnH2nO
3)Nomenclature :
Le
nom se déduit de celui de l'hydrocarbure correspondant en ajoutant la
terminaison al (jamais de numéro, car le groupement fonctionnel est toujours en
bout de chaîne).
Quelques
aldéhydes saturés:
HCHO
méthanal
CH3CHO
éthanal
CH3-CH2-CHO
propanal
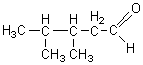
3,4-diméthylpentanal
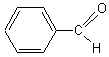 (C6H5-CHO)
(C6H5-CHO)
aldéhyde
benzoïque
4) Propriétés physiques
:
Le
méthanal est gazeux, les autres termes sont liquides ou solides.
teb:
HCHO -21°C
CH3CHO 21°C
CH3-CH2CHO 49°C
C6H5-CHO 179°C
La liaison C=O est polarisée (O plus électronégatif que C) avec +d pour C
et -d pour O.
Il y aura donc possibilité d'additions avec attaque du C par des réactifs
nucléophiles:
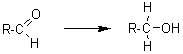
- Hydrogénation
par LiAlH4, suivie d'une hydrolyse;
c'est
une réaction spécifique et les liaisons éthyléniques ne sont pas hydrogénées.
Tout
se passe comme s'il s'agissait d'une addition du nucléophile H-
- Additions d'organo-magnésiens :
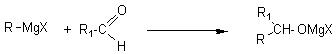
puis
par hydrolyse ![]() (alcool II)
(alcool II)
A
partir du méthanal (R1=H ) on obtient un alcool I.
Tout
se passe comme s'il s'agissait d'une addition du nucléophile R-
- Additions d'alcools: (acétalisation)
![]()
blocage
de la fonction carbonylée par formation d'un acétal; on peut ensuite régénérer
le
groupement
C=O par action de l'eau.
On
peut s'arrêter au stade de l'addition d'une seule molécule d'alcool, le composé
obtenu s'appelant hémiacétal:
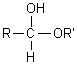 .
.
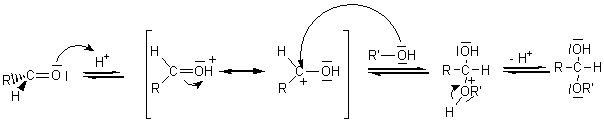
Mécanisme
de l'hémiacétalisation :
Mécanisme
de l'acétalisation:
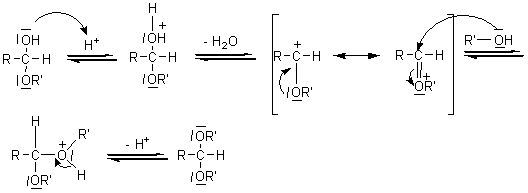
- Addition
de l'ammoniac et des amines primaires :
L'ammoniac
et les amines primaires R-NH2 donnent
avec les aldéhydes (mais aussi les cétones) des imines par addition conduisant
d'abord à un aminoalcool (aussi appelé hémiaminal par analogie aux hémiacétals),
qui se déshydrate.
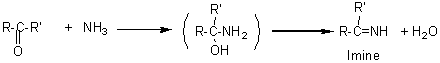
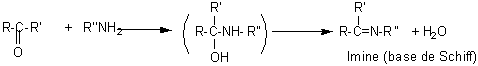
Mécanisme: nous
prenons l'exemple de l'action d'une amine primaire sur un composé carbonylé.
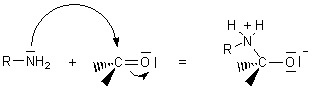
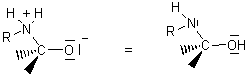
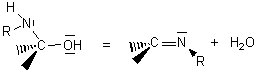
-Additions de cyanure d'hydrogène(formation
de cyanhydrines) :
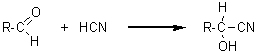 (Cyanhydrine)
(Cyanhydrine)
Les
cyanhydrines permettent la préparation des alpha acides alcools.
- 5-2) Hydrogénations catalytiques : (Ni catalyseur;température + pression)
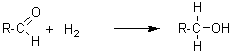
- 5-3) Mobilité des H voisins du groupement carbonyle :
- Enols : Dans l'eau, existence de 2
formes en équilibre R'-CH2-CHO (forme carbonylée) et
R'-CH=CH-OH (forme énolique) Ces 2 formes sont tautomères.
- Aldolisation
:
En
milieu basique (OH-) 2 molécules d'aldéhydes peuvent s'additionner
pour donner un aldol:
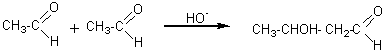 3-hydroxybutanal
3-hydroxybutanal
mécanisme:
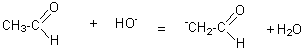
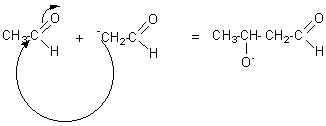
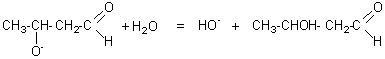
Une molécule d'aldéhyde et une
molécule de cétone peuvent réagir en milieu basique (cela est vrai ausi pour
deux molécules de cétone, mais le rendement est alors très faible) pour donner
un cétol; la réaction s'appelle alors cétolisation; c'est l'H en a du
carbonyle de la cétone qui est "arraché" par l'ion hydroxyde (voir
mécanisme de l'aldolisation):
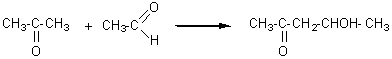
L'aldol
formé, peut être déshydraté, pour donner l'aldéhyde éthylénique:
CH3-CH=CH-CHO
(aldéhyde crotonique)
La
déshydratation est une crotonisation:
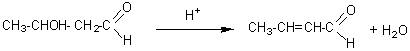
Un
cétol peut lui aussi être déshydraté dans les mêmes conditions (milieu
acide).
- 5-4) Réaction de CANNIZZARO :
Les aldéhydes sans H voisins (aromatiques,méthanal,...) donnent
lieu en milieu basique à une dismutation
(une molécule est oxydée, une molécule est réduite)
![]()
- 5-5) Caractérisation des aldéhydes (composé carbonylé) :
- Additions de l'hydrogénosulfite
de sodium :

Le
dérivé bisulfitique cristallisé,blanc permet de caractériser l'aldéhyde (point
de fusion).
- Condensation avec la 2-4-DNPH :

Le
composé formé, jaune orangé est la 2-4-dinitrophénylhydrazone de l'éthanal.
- Condensation avec l'hydroxylamine :
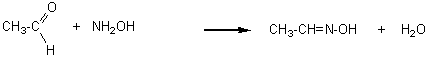
On
obtient une oxime, composé cristallisé, blanc,qui permet de caractériser
l'aldéhyde (point de fusion).
Remarque:
Ces trois réactions, ne permettent pas de distinguer aldéhydes et cétones.
- Mise
en évidence par le réactif de Schiff :
On
peut mettre en évidence les aldéhydes non aromatiques par action du réactif de Schiff (Fuchsine fraîchement décolorée
par SO2 ou les sulfites, qui prend une teinte mauve en présence d'
aldéhydes non aromatiques). Mais ce réactif peut aussi donner une coloration
avec les cétones aliphatiques méthylées et les cyclanones).
- Oxydation ménagée :
Industriellement,
phase gazeuse,O2 de l'air,80°C, acétate de Mn.
CH3CHO
+ 1/2 O2![]() CH3COOH
CH3COOH
- Action
des ions dichromates(Cr2O72-
en milieu acide) :
![]()
(CH3CHO
+ H2O![]() CH3-COOH + 2H+ + 2e-) x3
CH3-COOH + 2H+ + 2e-) x3
Le
bilan:
Cr2O72-
+ 3CH3CHO + 8H+![]() 3CH3-COOH + 2Cr3+ + 4H2O
3CH3-COOH + 2Cr3+ + 4H2O
- Action du nitrate d'argent ammoniacal
:
oxydant
doux; réaction particulière aux aldéhydes(ion diammine argent(I) [Ag(NH3)2]+
en milieu basique)
[Ag(NH3)2]+
+ e-![]() Ag + 2NH3
Ag + 2NH3
CH3CHO
+ 3HO-![]() CH3-COO- + 2e- + 2H2O
CH3-COO- + 2e- + 2H2O
Le
bilan:
2[Ag(NH3)2]+
+ CH3CHO + 3HO-![]() CH3-COO- + 2Ag + 4NH3 + 2H2O
CH3-COO- + 2Ag + 4NH3 + 2H2O
- Action de la liqueur de Fehling :
oxydant
doux; réaction particulière aux aldéhydes
2Cu2+complexé
+ 2HO- + 2e-![]() H2O + Cu2O(s)
H2O + Cu2O(s)
CH3CHO
+ 3HO-![]() CH3-COO- + 2e- + 2H2O
CH3-COO- + 2e- + 2H2O
Le
bilan:
2Cu2+complexé
+ CH3CHO + 5HO-![]() 3H2O + Cu2O(s) + CH3-COO-
3H2O + Cu2O(s) + CH3-COO-
- 5-7) Polymérisations et copolymérisations :
Phénoplastes et uréoplastes (voir polymères).
- 6-1)Oxydation d'alcools : (O2 de l'air en présence de Cu ou d'Ag 250°C)
R-CH2OH + 1/2O2![]() R-CHO + H2O
R-CHO + H2O
- 6-2)Déshydrogénation : (Cu 300°C)
R-CH2OH![]() R-CHO + H2
R-CHO + H2
- 6-3)Réduction d'un chlorure d'acide : (Pd désactivé)
R-COCl + H2![]() R-CHO + HCl
R-CHO + HCl
- 6-4)Organo-magnésien sur orthoformiate d'éthyle :
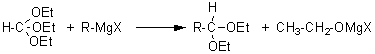
L'action de l'eau conduit ensuite
à R-CHO + 3 EtOH + 1/2 MgX2 + 1/2 Mg(OH)2
- 6-5)Oxo-synthèse :
R-CH=CH2 +CO +H2![]() R-CH2-CH2-CHO
R-CH2-CH2-CHO
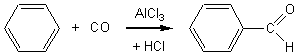 (aldéhyde benzoïque).
(aldéhyde benzoïque).
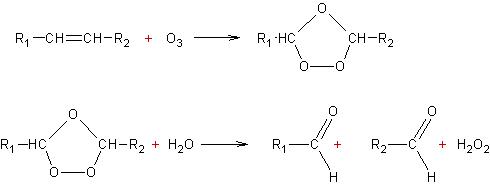
R1-CH=CH-R2 (+O3
puis H2O ) ![]() R1-CHO
+ R2-CHO
R1-CHO
+ R2-CHO
En détaillant :