EXERCICE 40
Corrigé
Enoncé
:
Détermination d'une
structure
On cherche à déterminer la structure d'un composé A. De masse molaire égale à
240,9 g.mol-1, il contient (en masse)
59,7% de carbone, 7,1% d'hydrogène et 33,2% de brome.
Données:
|
Elément |
C |
H |
Br |
|
Masse molaire(g.mol-1) |
12,0 |
1,0 |
79,9 |
1) Déterminer la
formule moléculaire de A.
2) Détermination de la structure de A:
On dispose des renseignements suivants:
a) Une étude spectroscopique de A montre la présence dans la
molécule d'un noyau benzénique;
b) A traité par une solution concentrée et chaude de potasse
(KOH) dans l'éthanol donne majoritairement un composé B;
c) l'ozonolyse de B suivie d'une hydrolyse en milieu
réducteur donne deux composés C et D;
d) C et D donnent un précipité jaune avec la 2,4-DNPH ;
e) C réduit la liqueur de Fehling ;
f) La formule moléculaire de D est C5H10O.
D ne réagit pas avec la liqueur de Fehling, ni avec le diiode
en milieu basique.
2.1. Indiquer les informations que
l'on peut tirer des renseignements d), e) et f).
2.2. Expliquer pourquoi D ne peut
être que la pentan-3-one.
2.3. Donner la formule
semi-développée de C ainsi que son nom, en expliquant le raisonnement suivi.
2.4. Donner la formule
semi-développée de B et son nom.
2.5. Structure de
A.
2.5.1. Donner la définition d'un atome de carbone asymétrique.
2.5.2. Donner la formule semi-développée de A, sachant qu'il possède un atome
de carbone asymétrique.
2.5.3. Représenter en perspective de Cram le stéréoisomère R de A en justifiant soigneusement la
démarche suivie.
3) D réagit avec le bromure de benzylmagnésium C6H5CH2MgBr
dans l'éther anhydre. Le mélange obtenu est hydrolysé à froid en milieu acide,
on obtient E.
3.1. Ecrire l'équation de la
réaction du bromure de benzylmagnésium sur D.
3.2. Expliquer pourquoi la réaction
a lieu dans l'éther anhydre.
3.3. Ecrire l'équation de la
réaction d'hydrolyse acide conduisant à E . Donner le
nom de E.
Corrigé :
1)
La somme des % des trois éléments vaut 100. Ce qui indique que seuls ces trois
éléments existent dans la molécule. La formule générale de A peut s'écrire : CxHyBrz.
On
peut écrire :
12x/59,7
= y/7,1 = 79,9z/33,2 = 240,9/100
On
en déduit :
x
= (240,9.59,7)/1200 = 12
y
= (240,9.7,1)/100 = 17
z = 240,9.33,2/(79,9.100)
d'où
x
= 6 y = 17 z = 1
La
formule moléculaire de A est : C12H17Br.
2) 2-1) C et D donnent un précipité jaune avec la 2,4-DNPH : C et D sont
des composés carbonylés (aldéhydes ou cétones) ; C réduit la liqueur de Fehling : C est un aldéhyde ; D ne réagit pas avec la liqueur de Fehling :
D n'est pas un aldéhyde ; ni avec le diiode en milieu basique : D n'est pas une cétone méthylée.
2-2) La seule cétone non méthylée ayant comme formule moléculaire C5H10O est la pentan-3-one.
2-3) La formule moléculaire de C est
: C7H6O ; en effet, un halogéno-alcane
traité par une solution chaude de potasse donne majoritairement un alcène par
élimination, celui-ci par ozonolyse donnera deux composés carbonylés avec
conservation du nombre de carbones. B ayant 12 carbones et D, 7 cela revient à
dire que C aura 5 carbones. D n'ayant pas de noyau benzénique, c'est C qui
l'aura. C étant un aldéhyde, sa formule semi-développée est obligatoirement :
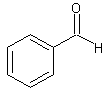
2-4) La formule semi-développée de B
est :
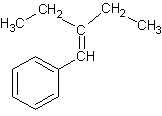
son nom : 1-phényl-2-éthylbut-1-ène
2-5) 2-5-1)
Un atome de carbone asymétrique est un atome de carbone portant quatre substituants différents (atomes ou groupements d'atomes).
2-5-2) La formule
semi-développée de A est :
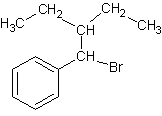
2-5-3) Stéréo-isomère R
de A :
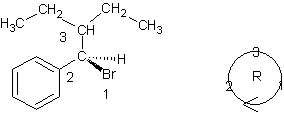
La
numérotation s'est faite selon la règle de Cahn-Ingold-Prelog.
3)
3-1)
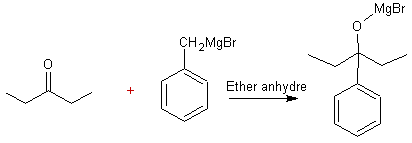
3-2) L'éther est un solvant de la
réaction ; la présence d'eau détruirait l'organomagnésien formé.
3-3) La réaction d'hydrolyse est :
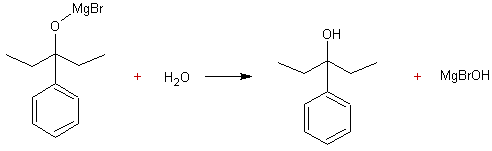
Le
nom de E est : 3-phénylpentan-3-ol.