EXERCICE 152
Corrigé
Enoncé :
L’anthranilate
de méthyle sert de répulsif à oiseaux mais est également utilisé en
parfumerie et dans l’industrie des arômes (on retrouve la molécule dans les
fleurs d’oranger, jasmin, acacia…).
Sa formule
semi-développée est :
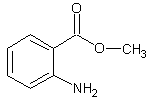
Pour réaliser sa
synthèse, on réalise une suite de réactions à partir du benzène.
·
Réaction
1 : on prépare le toluène
à partir de benzène et de chlorométhane.
·
Réaction
2 : le toluène est soumis à l’action du mélange sulfonitrique
à froid pour conduire à deux composés R1 (dérivé
ortho) et R2 (isomère de R1).
·
Réaction
3 : R1 est oxydé par les ions permanganate en milieu
acide ; on obtient le produit S.
·
Réaction
4 : S réagit avec un réactif approprié, en présence d’acide
sulfurique, pour conduire au 2-nitrobenzoate de
méthyle, composé T.
·
Réaction
5 : T est réduit par le dihydrogène en présence de carbonate de
cuivre (II) ; on obtient alors l’anthranilate de
méthyle.
1) Obtention du toluène.
1-1) Ecrire l’équation de la réaction en
précisant les conditions opératoires.
1-2) La réaction 1 est une
substitution : préciser si elle est nucléophile, électrophile ou
radicalaire.
1-3) Indiquer le nom de cette réaction.
2) Nitration
du toluène.
2-1) Donner les formules
semi-développées de R1 et R2.
2-2) Indiquer la formule de l’espèce
électrophile intervenant dans cette réaction.
3) Oxydation
de R1.
3-1) Après avoir écrit les
demi-équations électroniques, donner l’équation de la réaction 3, sachant que
les ions MnO4- sont réduits en ions Mn2+.
3-2) Nommer le composé S.
4) Obtention
de T.
4-1) Donner la formule
semi-développée et le nom du réactif nécessaire à la réaction 4.
4-2) Ecrire l’équation de la
réaction 4.
4-3) Indiquer le rôle de l’acide
sulfurique dans cette réaction et justifier son utilisation.
4-4) Préciser comment il est
possible d’augmenter le rendement de cette réaction, tout en gardant les mêmes
réactifs.
5) Obtention
de l’anthranilate de méthyle.
5-1) Ecrire l’équation de la
réaction 5.
5-2) Nommer l’anthranilate
de méthyle selon la nomenclature officielle.
Corrigé :
1)
1-1)
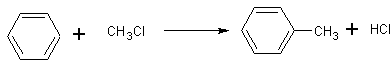
Présence d’un catalyseur : AlCl3 par
exemple (acide de Lewis).
1-2)
Substitution électrophile.
1-3) Alkylation de Friedel et Crafts.
2)
2-1)
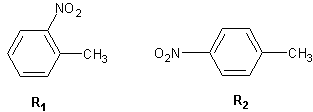
2-2) L’espèce électrophile intervenant est NO2+
3)
3-1)
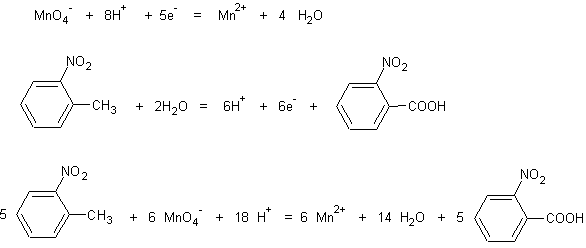
3-2) S : Acide 2-nitrobenzoïque
4)
4-1) Le réactif approprié est le
méthanol, CH3OH.
4-2)
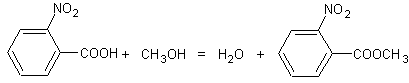
4-3) L’acide sulfurique joue le rôle
de catalyseur. Il accélère la réaction d’estérification mise en jeu ici.
4-4) On peut éliminer l’eau au fur
et à mesure de sa formation, ou mettre un fort excès d’un des réactifs.
5)
5-1)
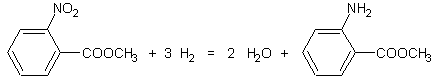
5-2) Le nom de l’anthranilate
de méthyle suivant la nomenclature officielle est : 2-aminobenzoate
de méthyle.