EXERCICE 140
Synthèse
d'un composé biologiquement actif : le gingérol.
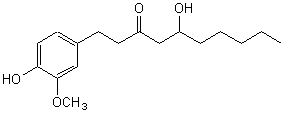
Le rhizome du gingembre (Zingiber
officinale Roscoe) est utilisé non seulement comme épice mais aussi comme
médicament au Japon et en Chine depuis fort longtemps. Il possède des
propriétés antiémétiques (contre les vomissements), diurétiques (augmentation
de la sécrétion urinaire), stimulantes et cardiotoniques. De nombreux travaux
d'extraction des principes actifs puis de détermination de leur structure et
enfin de synthèse de certains de ces principes actifs, dont le gingérol, ont été entrepris depuis les premiers travaux de Tresh en 1879.
De nombreuses synthèses du gingérol ont comme point
de départ la vanilline qui est une
des matières premières les plus importantes de l'industrie des arômes
synthétiques.
1) Synthèse de la vanilline à partir du benzène :
En 1882, Tiemann et Ludwig ont élaboré une synthèse
de la vanilline à partir du 3-nitrobenzaldéhyde. La
synthèse proposée ci-dessous s'inspire fortement de celle-ci.
1-1) La première étape consiste en la nitration du benzène.
1-1-1) Quels
réactifs peut-on utiliser pour effectuer cette réaction ?
1-1-2)
Quelles sont les conditions opératoires de cette réaction ?
1-1-3)
Détailler le mécanisme de cette réaction.
1-2) On fait réagir le nitrobenzène obtenu par la méthode de
Gattermann-Koch
:
l'action d'un mélange CO + HCl sur le nitrobenzène en
présence de chlorure d'aluminium conduit avec un très bon rendement au 3-nitrobenzaldéhyde.
1-2-1)
Proposer un mécanisme pour cette réaction en admettant que dans le milieu
réactionnel il se forme du chlorure de méthanoyle HCOCl par réaction entre CO et HCl.
1-2-2)
Quelle quantité de trichlorure d'aluminium AlCl3 faut-il utiliser
pour convertir une mole de nitrobenzène en 3-nitrobenzaldéhyde
?
1-2-3)
Justifier l'orientation de la réaction.
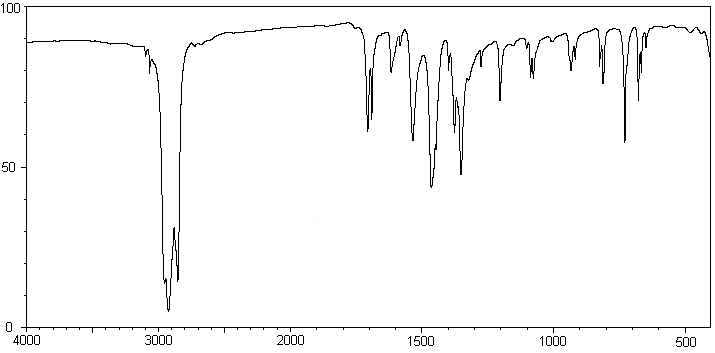
1-2-4)
Repérer (en utilisant la table des nombres
d'onde) sur le spectre I.R. du 3-nitrobenzaldéhyde,
représenté ci-dessous, les bandes caractéristiques de la structure de ce
composé.
1-3) L'action de l'étain en milieu acide chlorhydrique
concentré sur le 3-nitrobenzaldéhyde conduit à A
(composé ionique) et après passage en milieu basique, on obtient B (C7H7NO).
1-3-1)
Ecrire les équations de ces deux réactions sachant que l'étain Sn est
transformé en ion hexachlorostannate (IV).
1-3-2)
Donner la formule semi-développée et le nom de B.
1-4) On fait subir à B une réaction de diazotation puis on laisse remonter la température du
milieu réactionnel et on obtient C (C7H6O2).
1-4-1)
Indiquer les réactifs à utiliser et les conditions opératoires pour l'étape de diazotation.
1-4-2)
Ecrire l'équation de la réaction de diazotation de B.
1-4-3) Que
se passe-t-il quand on laisse la température du milieu réactionnel remonter ?
Ecrire l'équation de la réaction à envisager et identifier C (formule
semi-développée et nom).
1-5) C est traité par une solution aqueuse de soude
puis est soumis à l'action de l'iodure de méthyle. On obtient alors D.
1-5-1)
Ecrire les équations de ces deux étapes et identifier D (formule
semi-développée et nom).
1-5-2) A
quelle grande famille de réactions appartient la deuxième étape ? Détailler son
mécanisme.
1-6) La nitration de D conduit majoritairement à deux
isomères E1 et E2 que l'on doit séparer
pour continuer la synthèse. Expliquer pourquoi cette nitration conduit à un
mélange de deux isomères majoritaires et donner les formules semi-développées
de ces deux isomères. Quelle relation d'isomérie lie E1 et E2
?
1-7) E1, qui est le 3-méthoxy-4-nitrobenzaldéhyde, subit alors la suite de réactions :
réduction par l'étain en milieu acide chlorhydrique concentré, passage en
milieu basique, diazotation puis remontée de la
température du milieu réactionnel. Après toutes ces réactions, on obtient la
vanilline F (C8H8O3). Donner la formule
semi-développée et le nom systématique de la vanilline.
2) Synthèse du gingérol racémique à partir de
la vanilline.
2-1) L'action de la diméthylhydrazine
(CH3)2N-NH2 sur l'acétone (propanone) donne G
(C5H12N2).
2-1-1)
Ecrire l'équation de la réaction.
2-1-2)
Proposer un schéma réactionnel pour cette réaction.
2-2) L'action de la potasse alcoolique sur la vanilline
donne H, composé ionique, que l'on fait réagir avec du chlorure de
benzyle C6H5-CH2Cl. On obtient alors I.
I est réduit en J par le tétrahydruroborate
de sodium NaBH4 dans le méthanol. Le composé J est ensuite
soumis à l'action du chlorure de thionyle SOCl2
et donne alors K (C15H15ClO2).
2-2-1)
Identifier (formule semi-développée) H,I,J
et K.
2-2-2) A
quelle grande famille de réactions appartient la réaction permettant de passer
de H à I ? Détailler son mécanisme.
2-2-3) Dans
quel type de milieu le tétrahydruroborate de sodium
est-il stable ?
2-2-4) Quel
composé, autre que le tétrahydruroborate de sodium,
aurait-on pu utiliser pour passer de I à J ? Quelles précautions
aurait-il alors fallu prendre ?
2-2-5)
Ecrire l'équation de la réaction permettant de passer de J à K.
2-3) L'action de G sur K en présence d'une
base très forte (butyllithium C4H9Li
à -78°C dans le THF) donne L (C20H26N2O2).
2-3-1)
Sachant que G a le même comportement qu'une cétone en présence d'une
base forte, identifier le composé obtenu par action du butyllithium
sur G.
2-3-2) Ce
composé réagit alors sur K et conduit à L. Identifier L.
2-4) L'action d'une base très forte sur L (butyllithium à -78°C dans le THF)
suivie de l'action de l'hexanal conduit à M (C26H38N2O3).
L'hydrolyse de M par l'eau oxygénée à 30 volumes, dans le méthanol à pH
7, permet de régénérer la fonction cétone et conduit à N (C24H32O4).
Enfin l'action du dihydrogène en présence de palladium sur charbon conduit au gingérol.
2-4-1)
Identifier (formule semi-développée) M et N.
2-4-2) Le gingérol possède-t-il des stéréoisomères
? Si oui, quelle est la relation d'isomérie qui les lie ?
2-4-3) La
synthèse proposée conduit à un mélange équimolaire de ces deux stéréoisomères. Retrouver, dans la synthèse proposée,
l'étape clé lors de laquelle on forme ces deux stéréoisomères.
2-4-4) En
fait, seul le (+)-(S)-gingérol a une activité
cardiotonique intéressante. Le représenter et indiquer la signification de la
notation(+).