EXERCICE 163
De
l'ammoniac au diazépam, de l'acide nitrique au musc ambrette.
L’ammoniac est très
présent dans l’industrie des engrais avec notamment la synthèse de l’urée et autres composés inorganiques. Divers
produits organiques tels que les amides, les amines, les nitriles sont issus de
réactions impliquant l’ammoniac.
L’ammoniac est aussi
à l’origine de l’acide nitrique présent dans l’industrie des explosifs et de l’acide
adipique qui permet de synthétiser le Nylon. Les rétrosynthèses font
souvent appel à l’ammoniac ou l’acide nitrique : les synthèses du diazépam
ou du musc ambrette en sont deux exemples.
1.
A
partir de l’ammoniac :
Les synthèses de l’urée, des amides,
des amines et d’autres composés azotés mettent en jeu
l’ammoniac.
1-1) Synthèse de l’urée :
L'urée naturelle, découverte en 1773
par Hilaire Rouelle, est formée dans le
foie lors du cycle de l'urée à partir de l’ammoniac provenant de la dégradation
des acides aminés. Il est éliminé par l'urine. Sa synthèse en 1828 par Friedrich Wöhler a montré
qu’il est possible de synthétiser un composé organique, en dehors d'un
organisme vivant. Cette expérience marque le début de la chimie organique et la
fin de la théorie de la force vitale de Berzelius. Wöhler synthétisa l'urée par
isomérisation spontanée en évaporant une solution aqueuse d’isocyanate
d’ammonium CON2H4, constituée d’ions ammonium et d’ions
isocyanate OCN -.
1-1-1) La première synthèse de l’urée par Wöhler
1-1-1-1) L’urée a la formule brute CON2H4 :
quelle est sa formule semi-développée, sachant que l’atome de carbone est
trigonal ?
1-1-1-2) Ecrire le schéma de Lewis de chacun
des ions présents dans l’isocyanate d’ammonium, sachant que pour l’ion
isocyanate, l’atome de carbone est central et digonal.
1-1-1-3) Quelle relation existe-t-il entre
l’urée et l’isocyanate d’ammonium ?
1-1-1-4) Que signifie réaction
d’isomérisation ?
1-1-1-5) Ecrire l’équation de la réaction de
synthèse de l’urée.
1-1-2) Synthèse
industrielle
Industriellement,
l’urée est uniquement produite par réaction de l’ammoniac avec le dioxyde de
carbone. Ce dernier étant un co-produit de la synthèse de l’ammoniac à partir
du gaz naturel, on trouve de nombreuses unités de production ammoniac-urée
intégrées, permettant ainsi des économies d’énergie. Le principe d’obtention
consiste à faire réagir CO2 et NH3 sous forte pression et
à des températures élevées. On obtient alors du carbamate d’ammonium NH2CO2NH4 qui est ensuite déshydraté
en urée.
1-1-2-1) Ecrire
le schéma de Lewis de chacun des ions présents dans le carbamate d’ammonium.
1-1-2-2) Ecrire l’équation de formation du
carbamate d’ammonium NH2CO2NH4, puis celle de la
réaction de synthèse de l’urée.
1-1-3) Résines
urée-formol
1-1-3-1) Qu’est-ce que le formol ?
Comparez-le au méthanal.
1-1-3-2) Quelle réaction peut avoir lieu
entre l’urée et le formol (ou plutôt le méthanal) ?
1-2) Synthèse de l’acrylonitrile
1-2-1) L’acrylonitrile
(propènenitrile)
1-2-1-1) Ecrire son schéma de Lewis.
1-2-1-2) Préciser pour chaque atome de
carbone s’il est tétragonal, trigonal ou digonal.
1-2-1-3) Ecrire la(les) forme(s) mésomère(s).
Justifier.
1-2-2) L’obtention
de l’acrylonitrile
L’acrylonitrile est
obtenu par la réaction suivante :
CH2=CH-CH3
+ NH3 + O2
à CH2=CH-CN + ….
1-2-2-1) Quel est l’autre produit formé au
cours de cette réaction ?
1-2-2-2) Compléter
l’écriture de l’équation en ajoutant la molécule supplémentaire formée et en
ajustant éventuellement les nombres stœchiométriques.
1-2-3) Utilisation de l’acrylonitrile
L’acrylonitrile est une matière première utilisée dans
l’industrie des textiles synthétiques.
1-2-3-1) Ecrire le motif du polymère obtenu à
partir de l’acrylonitrile.
1-2-3-2) Ecrire l’équation de la réaction de
polymérisation.
1-2-3-3) Quel est le type de mécanisme à
envisager dans cette réaction ?
1-3) Synthèse d’un amide
1-3-1) Obtention
d’un amide à partir d’un chlorure d’acide ou d’un anhydride
L’ammoniac réagit
(réaction 1) avec le chlorure d’éthanoyle de façon stœchiométrique : le
composé 1 est obtenu. Pour obtenir l’amide, il est nécessaire de faire réagir
(réaction 2) deux fois plus d’ammoniac que de chlorure d’éthanoyle.
1-3-1-1) Ecrire l’équation de la réaction 1.
1-3-1-2) Ecrire l’équation de la réaction 2.
1-3-1-3) Quelle est la propriété de
l’ammoniac mise en jeu dans cette réaction ? Quelle est celle du chlorure
d’éthanoyle ? Justifier vos réponses.
1-3-1-4) Ecrire l’équation de la réaction 1
avec l’anhydride éthanoïque.
1-3-2) Application
à la synthèse de l’acétanilide
L’acétanilide (ou N-phényléthanamide) peut
être obtenu à partir de l’aniline.
1-3-2-1) Indiquer le(les) réactifs(s)
nécessaire(s) pour la préparation de l’acétanilide.
1-3-2-2) Ecrire l’(les) équation(s) de
réaction correspondante(s).
1-4) Synthèse d’une amine
1-4-1) L’ammoniac
est à l’origine des amines par réaction avec un alcool ou un dérivé
monohalogéné.
1-4-1-1) Ecrire les équations de réaction
permettant d’obtenir la méthylamine à partir de l’alcool correspondant.
1-4-1-2) Ecrire les équations de réaction
permettant d’obtenir la méthylamine à partir du dérivé monohalogéné convenable.
1-4-2) Application :
synthèse du diazépam
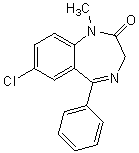
Le diazépam (principe actif du Valium) est un composé de
la famille des benzodiazépines, produits les plus connus permettant de traiter
l’anxiété (voir annexe 1).
Le point de départ de
cette synthèse est l’aniline (C6H5NH2) A
transformée (réaction 1) en acétanilide (C6H5NHCOCH3)
B, chloré (réaction 2) ensuite en C (4-chloroacétanilide), sur lequel on fait réagir
le chlorure de benzoyle (réaction 3) en présence de chlorure
d’aluminium, ce qui permet d’obtenir le composé D ; D est
ensuite hydrolysé (réaction 4) en E
(formule moléculaire : C13H10ONCl) dans lequel la
fonction amine est régénérée. La fonction amine est ensuite transformée en
fonction amide avec le chlorure de l’acide bromoacétique ClCOCH2Br,
ce qui permet d’obtenir le composé F. L’ammoniac intervient alors et transforme
le dérivé monohalogéné en amine primaire G. Le composé G est ensuite déshydraté
de façon intramoléculaire puis enfin méthylé pour donner le diazépam.
1-4-2-1) Comment chlorer l’acétanilide afin
d’obtenir le composé C ?
1-4-2-2) Quel est le rôle du chlorure
d’aluminium dans la réaction 3, vis-à-vis du chlorure de benzoyle C6H5COCl ?
Quelle est la nature de la réaction qui se produit ?
1-4-2-3) Justifier la fixation du groupe C6H5CO
en position 2 par rapport à la fonction amide.
1-4-2-4) Ecrire l’équation de la réaction 3.
Quelles sont les précautions à prendre dans cette réaction ? Comment
faire ?
1-4-2-5) Identifier le composé E.
1-4-2-6) Ecrire l’équation de la réaction
entre l’amine aromatique E et le chlorure de l’acide bromoacétique ClCOCH2Br.
1-4-2-7) Ecrire l’équation de la
transformation Fà G.
1-4-2-8) Quelles sont les fonctions chimiques
présentes dans le composé G ?
1-4-2-9) Quelles sont celles qui peuvent
réagir entre elles ? Justifier.
2.
A partir de l’acide nitrique
L’acide nitrique exerce en chimie
organique le rôle d’oxydant, d’acide et d’agent nitrant.
2-1)
L’acide nitrique oxydant : l’acide adipique
2-1-1) Procédé de fabrication
L'oxydation du mélange
cyclohexanol-cyclohexanone par l'acide nitrique, conduit à une co-production
d'acide adipique et de protoxyde d'azote gazeux (N2O), dans la
proportion d'environ 0,3 tonne de protoxyde d’azote pour 1 tonne d'acide
adipique. A la fin des années 1990, l'unité française a choisi, pour réduire
ses émissions de N2O, la technique de conversion en acide nitrique
(recyclé) et diazote (rejeté à l'atmosphère). Cette technique - dont les
investissements ont été exclusivement financés par l’industriel - a permis de
réduire d’environ 90 % les émissions de N2O, ce qui a entraîné entre
1997 et 2000 (et ce malgré une augmentation de production de 25 %), une
réduction de 15 millions de tonnes de dioxyde de carbone soit plus de 4 Mt éq C (voir annexe 2).
2-1-1-1) Ecrire l’équation de réaction de l’étape 1 du
processus représenté en annexe 2. Quel est le rôle du nickel et celui de
l’alumine ? Quelle est la grandeur qui est exprimée en psi ? Quelle
est son unité dans le
système
international ?
2-1-1-2) Ecrire
l’équation de la réaction qui traduit la transformation du cyclohexane en
cyclohexanone grâce au dioxygène en présence de cobalt.
2-1-1-3) Ecrire les deux
demi-équations d’oxydo-réduction mises en jeu dans la transformation
cyclohexanone-acide adipique.
2-1-2) Utilisation de l’acide adipique
L'acide adipique est l’un des deux
produits intermédiaires de base dans la fabrication du "Polyamide
6,6" encore appelé « NYLON 6,6 », lorsqu’il réagit avec
l’hexaméthylène diamine.
2-1-2-1) Ecrire l’équation de la
réaction entre une mole d’acide adipique et une mole d’hexaméthylène
diamine (ou hexane-1,6-diamine).
2-1-2-2) Préciser les groupes fonctionnels présents dans le composé formé.
2-1-2-3) Si on poursuit la réaction, un
polymère se forme : quel en est le motif ?
2-1-2-4) L’acide adipique peut-il être un
conservateur alimentaire ? Justifier.
2-2) L’acide nitrique acide : la nitroglycérine
La nitroglycérine a
été découverte par Ascanio Sobrero en 1847, lorsqu'il travaillait avec Théophile-Jules Pelouze à
l'université de Turin. Le processus de fabrication industriel a été élaboré par
Alfred Nobel dans les
années 1860. Sa société a exporté un mélange de nitroglycérine et de poudre à
canon appelé « huile suédoise détonante », qui a été rapidement
interdit suite à des accidents catastrophiques. Il découvrit également en 1866
qu'on pouvait stabiliser la nitroglycérine en la mélangeant à un sable siliceux
d'origine naturelle : le kieselguhr. Cette découverte a ensuite abouti au
développement de la dynamite.
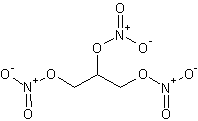
La nitroglycérine ou ester
trinitrique du glycérol (voir annexe 3) est un composé chimique liquide
dense, incolore, huileux et hautement toxique, obtenu par nitration du glycérol. Elle est utilisée dans la
fabrication d'explosifs, et plus particulièrement de la dynamite, dont on se
sert dans les industries de la construction et de la démolition. Elle peut
également avoir un usage médical, comme vasodilatateur. Lors de sa
décomposition, la nitroglycérine prend une teinte jaune en raison de
l'acidification du milieu.
2-2-1) Formation de la nitroglycérine
2-2-1-1) Ecrire la
formule semi-développée de la nitroglycérine. Donner son nom en nomenclature
IUPAC, sachant que le groupe ONO2 se nomme nitrooxy.
2-2-1-2) Quel type de réaction
se produit pour former ce composé lorsqu’on fait réagir l’acide nitrique avec
le glycérol (ou propan-1,2,3-triol) ?
2-2-1-3) Ecrire l’équation de formation du trinitrate de glycérol (ou
nitroglycérine).
2-2-2) Utilisation
de la nitroglycérine
Les molécules explosives n’empruntent pas
l’oxygène nécessaire à leur « combustion » au milieu extérieur. Elles
portent souvent des fonctions chimiques riches en oxygène telles que –NO2 et –ONO2 qui
permettent l’oxydation partielle ou totale des autres atomes de la molécule. Un
explosif est dit suroxygéné ou à combustion complète lorsque sa structure
chimique comporte plus d’atomes d’oxygène qu’il n’est nécessaire pour assurer
l’oxydation totale des atomes de carbone et d’hydrogène le constituant.
Un calcul élémentaire permet de
déterminer si une substance est sur- ou sous-oxygénée.
Soit un explosif de formule brute
CxHyOzNu :
·
si z ³ 2x + y/2, l’explosif
est sur-oxygéné.
·
si z < 2x + y/2, l’explosif est
sous-oxygéné.
Les explosifs modernes possèdent
une balance en oxygène équilibrée ou légèrement positive. (Extrait de
L’actualité chimique, juillet-août 2000, Etude synoptique des explosifs, par
Hervé Fuzelier et Marc Comet)
2-2-2-1)
Ecrire l’équation de la réaction de combustion complète d’un hydrocarbure de
formule brute CxHy dans le dioxygène.
2-2-2-2)
Retrouver la condition entre x, y et z pour qu’un explosif de formule CxHyOzNu
soit sur-oxygéné.
2-2-2-3) La nitroglycérine est-elle sur- ou sous-oxygénée ?
2-2-2-4) Ecrire l’équation de la réaction de décomposition de la
nitroglycérine.
2-2-2-5)
Comment expliquer que cette réaction de décomposition soit explosive ?
2-3) L’acide
nitrique, agent nitrant : nitration
Les composés nitrés résultent de l’action de l’acide nitrique concentré
avec les composés aromatiques. Ils ont une importance industrielle en tant
qu’explosifs. Mais ce n’est pas la seule utilisation. Cette réaction entre dans
les processus de rétrosynthèse. C’est ainsi que le musc ambrette a été découvert,
en tant que sous-produit de la chimie des explosifs. Il a été pendant longtemps
un musc très utilisé car sa synthèse est simple et peu coûteuse, mais sa
toxicité par contact avec la peau a entraîné son interdiction.
2-3-1) Synthèse du trinitrotoluène
2-3-1-1)
Le trinitrotoluène est-il sur- ou sous-oxygéné ?
2-3-1-2)
Comment synthétiser le trinitrotoluène à partir du toluène ?
2-3-1-3)
Ecrire l’équation de la réaction.
2-3-1-4)
Justifier la facilité de formation du dérivé trinitré.
2-3-2) Synthèse
du musc ambrette
Le benzène A est transformé (réaction 1) en
nitrobenzène B puis (réaction 2) en 3-méthylnitrobenzène C, puis (réaction 3)
en 3-méthylaniline D, puis (réaction 4) en 3-méthylphénol E, puis (réaction 5)
en 3-méthylméthoxybenzène F, puis (réaction 6) en
4-tertiobutyl-3-méthyl-méthoxybenzène G. Ce dernier réagit (réaction 7) avec
l’acide nitrique en excès en présence d’anhydride acétique. On obtient alors le
composé H, de formule brute C12H16O5N2.
2-3-2-1)
Préciser les réactifs qui interviennent dans les réactions 1, 2, 3.
2-3-2-2). Comment transformer le composé D en E ? Quels réactifs ?
Quelle condition opératoire ? Quel type de réaction ?
2-3-2-3) Comment expliquer la fixation du groupe méthyle
sur l’atome d’oxygène dans la réaction
5 ? Quel type de réaction se produit ? Dans quel milieu la réaction
est-elle favorisée ?
2-3-2-4) Quel réactant réagit avec F, et dans quelles conditions, pour donner
G ?
2-3-2-5) Dans
la réaction 7, quel est le rôle de l’anhydride acétique ? Justifier
l’orientation de la réaction. Ecrire l’équation de la réaction.
Annexes
Annexe
1 :
Diazépam
Annexe
2 : Synthèse de l’acide adipique :
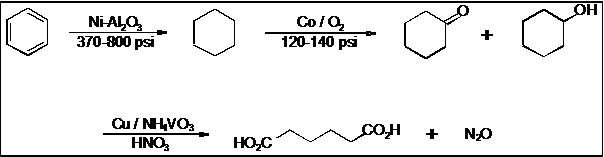
Annexe
3 :
Nitroglycérine