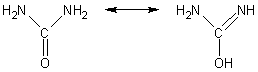
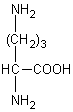UREE
L'urée est une substance importante d'un point de vue historique mais
aussi en biologie et industriellement.
1) Aspect historique :
En 1828 Wöhler réalise la première synthèse organique, celle de l'urée,
à partir de substances réputées minérales ; à cette époque, ce qui était
relatif au vivant était considéré comme organique et tout ce qui concernait
l'inerte était qualifié de minéral.
Wöhler essayait de préparer du cyanate d'ammonium (NH4+
-O-CN) par réaction du cyanate d'argent (Ag+ -O-CN) sur le chlorure d'ammonium NH4Cl
:
Ag+ -O-CN + NH4Cl = AgCl
+ NH4+ -O-CN
A sa grande surprise il obtint lors de l'évaporation de la solution des
cristaux d'urée ; le cyanate d'ammonium s'isomérise en effet facilement en urée
:
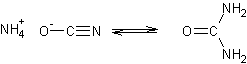
Cela fit sensation car l'urée était, depuis sa découverte en 1773 par
Hilaire-Marin Rouelle (1748-1779) (frère cadet de Guillaume-François Rouelle(1703-1770)
un autre grand chimiste), considérée comme un composé organique et le monde
scientifique (Berzélius en particulier, maître de Wöhler) était alors
convaincu qu'une force vitale ("vis vitalis") était nécessaire à
l'élaboration des composés touchant au vivant ; "Je peux faire de l'urée
sans avoir besoin de reins ou même d'un animal…." déclare Wöhler ; il
devenait de cette façon le fondateur de la chimie organique de synthèse.
L'urée est chez l'homme le
produit ultime de dégradation des composés azotés c'est-à-dire essentiellement
des protéines.
C'est un solide blanc qui
cristallise en aiguilles prismatiques incolores, qui fond vers133°C, très
soluble dans l'eau (environ dans son poids d'eau froide), de masse molaire
faible (60 g.mol-1) ce qui le rend très diffusible, très riche en
azote (47%) et non toxique ; l'urée est facilement éliminée par les reins,
l'urine humaine en contient 20g.L-1 et un adulte en élimine environ
30g par jour. Le plasma sanguin contient 0,30g d'urée par litre, la sueur
1g.par litre.
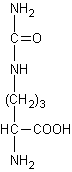
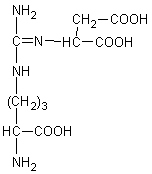
Le cycle de l'urée, identifié en 1932 notamment par
Krebs, qui se déroule dans le foie est le suivant :
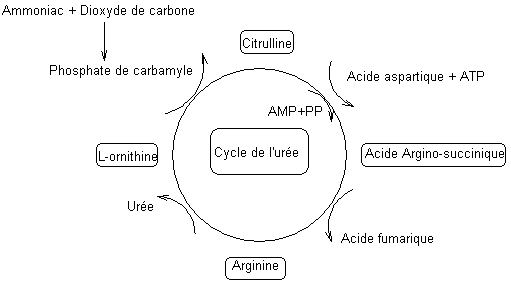
Avec :
|
Citrulline
|
Acide aspartique
|
Acide argino-succinique
|
|
Acide
fumarique
|
Ornithine
|
Urée
|
|
Phosphate de carbamyle
|
|
|
3) L'urée en chimie et
dans l'industrie :
3-1) Caractère basique de l'urée :
L'urée est très faiblement
basique (pKa = 0,10 à comparer à celui du couple NH4+/NH3,
9,2). Ce caractère s'explique par la forme énolique de la molécule :
![]()
L'action de l'acide
nitrique sur une solution concentrée d'urée conduit à un précipité bien
cristallisé de nitrate d'urée :
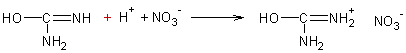
Il en est de même pour
l'acide éthanedioïque (oxalique), l'oxalate d'urée correspondant à la formule :
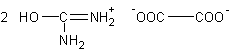
3-2) Hydrolyse de l'urée :
C'est par ces réactions que l'urée utilisée comme
engrais (et grâce à l'humidité du sol) apporte aux végétaux l'azote ammoniacal
dont ils ont besoin.
3-2-1) En milieu acide fort ou base
alcaline :
Si l'on fait bouillir de
l'urée avec une solution d'acide fort on obtient du dioxyde de carbone et des
ions ammonium :
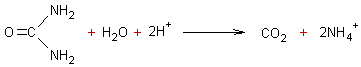
Si l'on fait bouillir de
l'urée avec une base alcaline, on obtient des ions carbonates et de l'ammoniac
:
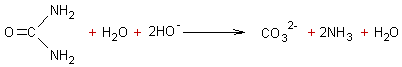
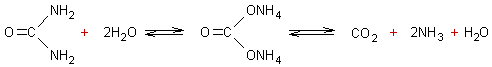
3-2-2) Dans l'eau seule :
En portant à ébullition
une solution d'urée dans l'eau, l'hydrolyse n'est que partielle et donne du
carbonate d'ammonium lui-même plus ou moins complètement hydrolysé en dioxyde
de carbone, ammoniac et eau :
3-2-3) Hydrolyse
enzymatique :
A froid et en présence
d'uréase, une enzyme spécifique, l'urée est complètement hydrolysée ; le pH optimal
pour cette hydrolyse étant 7 on opère en présence d'un mélange tampon donnant
ce pH :
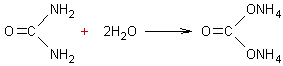
On trouve l'uréase dans le
monde végétal, dans la fève de soja par exemple (glycine hyspida L.) par
exemple ou dans la fève Jacques (canavalia
ensiformis).
Remarque :
Cette hydrolyse enzymatique
est à la base d'une technique précise de dosage de l'urée par une méthode en
retour dont le principe est le suivant :
On porte à ébullition la
solution à doser qui a préalablement été alcalinisée ; il se dégage de
l'ammoniaque que l'on recueille dans une solution sulfurique titrée, en excès.
On dose par une base forte l'excès d'acide restant et par différence on peut en
déduire la quantité d'ammoniac dégagée et donc la quantité d'urée initialement
présente dans l'échantillon.
3-3) Déshydratation de
l'urée :
On peut par action du
dichlorure de thionyle déshydrater l'urée pour obtenir le cyanamide hydrogène,
cette substance est présente dans certains produits phyto-sanitaires avec un
rôle de régulateur de croissance :
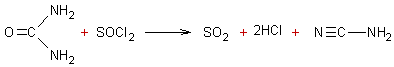
3-4) Oxydation de l'urée par l'hypobromite de sodium
en milieu alcalin :
- A une température inférieure à 8°C
l'oxydation conduit à l'hydrazine :
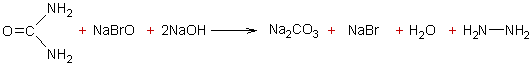
- A partir de 8°C l'hydrazine est oxydée et
il y a dégagement de diazote ; l'équation globale devient :
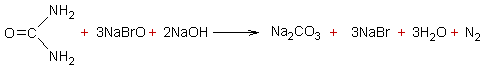
La mesure d'azote dégagé
peut constituer une méthode (peu précise) de dosage de l'urée. Le manque de
précision étant dû au fait qu'il y a des réactions secondaires et que le volume
de diazote recueilli est toujours inférieur au volume que la stoechiométrie permettait
de prévoir.
3-5)
Obtention de l'acide isocyanique, du biuret, de l'acide
cyanurique :
-
Si on chauffe de l'urée sèche, dans un tube à essai par exemple, il fond ; on
perçoit en même temps un dégagement d'ammoniac et la condensation d'un composé
blanc se produit sur la paroi du tube, c'est l'acide isocyanique :
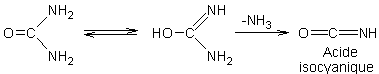
-
Si on continue de chauffer l'urée fondue présente dans le tube on voit, entre 140°C
et 180°C, un solide se prendre en masse, il s'agit du biuret : H2N-CO-NH-CO-NH2
; c'est en fait la réaction entre l'urée et l'acide isocyanique qui conduit au
biuret :
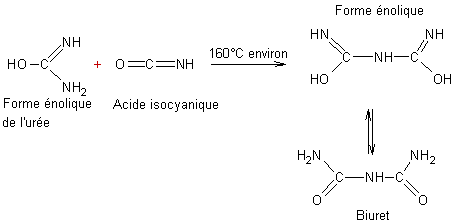
-
Après refroidissement, si on ajoute de la soude et quelques gouttes de sulfate
de cuivre (II) on obtient une coloration violette. Cette réaction qui est dite
"du biuret" n'est en fait pas spécifique de ce composé ; elle se
produit avec les groupes –CO-NH- c'est-à-dire les liaisons peptidiques et sert
à détecter ces liaisons
(il en faut un minimum de 3 pour qu'on aperçoive la couleur) et donc les
protides.
- A
température supérieure à 190°C le biuret se décompose en redonnant l'acide
isocyanique qui se trimérise en acide cyanurique dont le nom, selon la
nomenclature officielle, est l'acide 1,3,5-triazine-2,4,6(1H,3H,5H)-trione :
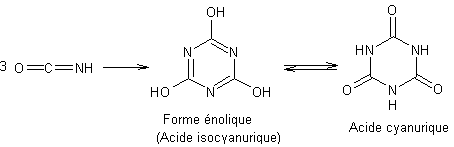
Globalement à partir de
l'urée on peut écrire :
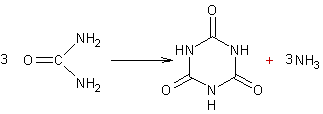
L'acide cyanurique est
utilisé dans l'entretien des piscines comme stabilisant des produits chlorés.
3-6) Condensation avec les
aldéhydes- Les aminoplastes :
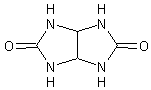
- L'urée peut se condenser avec les
aldéhydes. Avec l'éthanedial (glyoxal) par exemple, elle conduit à l'acétylène
diurée matière première de synthèse pour certains produits utilisés pour
traiter les textiles :
-
avec le méthanal en solution à environ 40% (formol) elle donne des résines
thermodurcissables dîtes résines urée-formol. La réaction a lieu en présence
d'ammoniac ou d'hexaméthylènediamine comme catalyseur. Le produit obtenu est
visqueux ; il peut servir à l'imprégnation des tissus ; en le faisant durcir
sous pression, à chaud et en présence d'acide, on peut en faire des verres
organiques car le matériau obtenu est transparent et infusible ; on peut
également lui adjoindre des charges (cellulose par exemple) et des pigments et
procéder à des moulages (vaisselle).
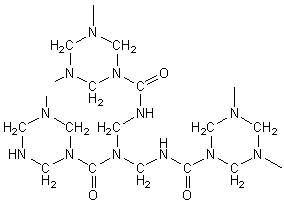
Le principe de la condensation est le suivant :
désignons l'urée par R-NH2 :

Un aperçu du polymère
tridimensionnel obtenu (aminoplaste) :
3-7) Les uréides :
Ces composés également
appelés acylurées s'obtiennent par action de l'urée sur un chlorure d'acyle, un
anhydride d'acide, un ester.
On citera surtout ceux
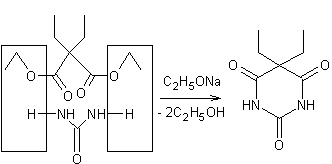
obtenus par action de l'urée sur un diester de l'acide malonique (qui est un
diacide) ou ses dérivés :
- avec l'urée et du dimalonate d'éthyle diéthylé sur
le carbone, on obtient le véronal ou barbital.
- avec l'urée et du dimalonate d'éthyle éthylé et phénylé
sur le carbone, on obtient le gardénal.
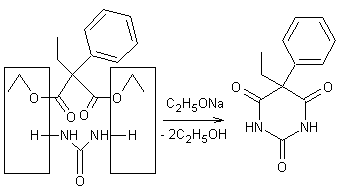
Véronal et gardénal sont
des barbituriques (c'est-à-dire des dérivés de l'acide barbiturique)
qui ont été utilisés comme
calmants somnifères et hypnotiques.
Le véronal a été le premier barbiturique à être élaboré ; c'est Emil Fischer en collaboration avec le médecin Joseph von Mering
(1849-1908) (Professeur à Halle) qui le synthétisa pour la première fois en
1903.
Le gardénal a été préparé en 1912 par Heinrich Hörlein (1882-1954 ;
élève de Knorr ; chimiste à l'usine Bayer de Leverkusen). Il a
une action particulièrement prolongée.
3-8) Composés
moléculaires :
Les alcanes, alcènes, alcools, dérivés halogénés, acides, esters,
cétones, non ramifiés peuvent
dans un solvant anhydre, donner des composés d'addition bien cristallisés qui
par action de l'eau redonnent l'urée et l'autre molécule (le nombre de moles
d'urée qui s'additionnent est fonction de la longueur de la chaîne, ainsi pour
une mole d'heptane il faut 6 moles d'urée et pour une mole de l'alcane en C28
il en faut 21). Cette propriété a été employée pour l'analyse des carburants et
leur raffinage.