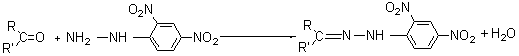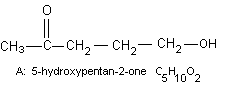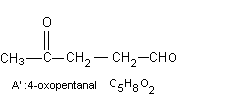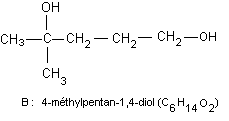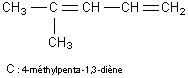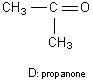EXERCICE 2
Analyse organique
Enoncé
a) La structure d'un composé organique A de
formule brute C5H10O2 a été déterminée
comme
suit: A donne un précipité jaune avec la 2-4
DNPH, mais ne réagit pas avec le
réactif de Tollens
(solution aqueuse de l'ion [Ag(NH3)2]+).
En IR, A présente,
entre autres, un pic d'absorption fin et intense vers 1700cm-1 ainsi
qu'une
bande large et intense vers 3300cm-1.
Ecrire
l'équation de la réaction de la fonction active de A avec la 2,4-DNPH.
b) A soumis à l'action de CrO3 en solution dans la
pyridine, conduit à A' de formule C5H8O2
qui ne présente plus en IR, d'absorption vers 3300
cm-1 et qui donne un miroir d'argent avec le réactif de Tollens.
Ecrire l' équation de
réaction de la fonction active de A' avec le réactif de Tollens.
c) A une mole de A en solution dans l'éther anhydre, on
ajoute deux moles d'iodure de méthylmagnésium.
Il se dégage une mole d'un composé gazeux. Après
hydrolyse du mélange réactionnel, on obtient un
composé unique B (C6H14O2)
qui ne présente plus, en IR, d'absorption vers 1700 cm-1. B est
déshydraté
en un composé C : C6H10.
Ecrire les chemins de réactions des fonctions
actives de A qui ont eu lieu. Indiquer la nature du gaz
dont on a observé la formation.
d)L'ozonolyse de C suivie
d'une hydrolyse en milieu réducteur fournit un mélange en quantités égales
de 3 composés D,E,F. Ces trois composés sont
séparés par une méthode convenable. Le composé
D est identique au produit de la réaction du propan-2-ol avec une solution
aqueuse acide d'oxyde
chromique.
Une solution aqueuse de E conduit au méthanol par
action de NaBH4.
L'oxydation de F donne l'acide oxalique (ou éthanedioïque).
Déduire de l'ensemble de ces indications la
formule des composés A à F.
Corrigé
a) - précipité jaune avec la 2-4 DNPH : Le composé possède un groupement carbonyle C=O.
- ne réagit pas avec le réactif de Tollens :
Le composé n'a pas de fonction aldéhyde, il possède
donc une fonction cétone.
- En IR, A présente, entre autres, un pic
d'absorption fin et intense vers 1700cm-1:
cela confirme
la présence d'un groupement carbonyle.
- ainsi qu'une bande large et intense vers 3300cm-1:présence probable d'une fonction
alcool.
b) - par oxydation (CrO3) la fonction
alcool est oxydée en aldéhyde (C5H8O2 ne présente plus
en
IR, d'absorption vers 3300 cm-1 ( disparition
de la fonction alcool) et donne un miroir d'argent
avec le réactif de Tollens ( présence d' une fonction
aldéhyde).
oxydant
[Ag(NH3)2]+ + e-![]() Ag
+ 2 NH3
(x2)
Ag
+ 2 NH3
(x2)
réducteur R1 -CHO
+ 3OH-![]() R1 -COO-
+ 2H2O + 2e-
R1 -COO-
+ 2H2O + 2e-
bilan
2 [Ag(NH3)2]+ + R1 -CHO + 3OH-![]() R1 -COO-+2H2O
+ 2 Ag + 4 NH3
R1 -COO-+2H2O
+ 2 Ag + 4 NH3
c) 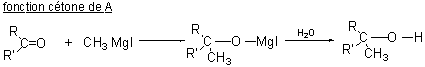
Le gaz qui s'est dégagé est du méthane.
Le composé B aura donc 2 fonctions alcool dont l' une
sera primaire.
La disparition de la bande à 1700cm-1s'explique par la disparition de
la fonction cétone.
Le composé C sera doublement déshydraté à partir de ses deux fonctions alcool
(disparition de 2 molécules d'eau ainsi que le montre sa formule brute); il
possédera
2 doubles liaisons C=C.
d) Remarque :ces 3 composés D,E,F
obtenus par ozonolyse en milieu réducteur, sont
des composés carbonylés.
Le composé D sera de la propanone (obtenue par oxydation du propan-2-ol).
La réduction douce de E (par NaBH4) conduisant à du méthanol, on
dira que E est du méthanal.
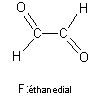
L'oxydation de F conduisant à de l'acide éthanedioïque
on dira que F est de l'éthanedial.