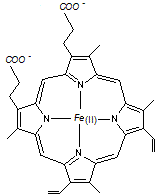LA QUININE ET D'AUTRES ANTIPALUDEENS
Gérard Gomez
avec la collaboration de
Jacques Baron
Plan de l'étude
1) Le paludisme
2) La quinine
2-1) Présentation
2-2) Mécanisme
d'action
3) L'artémisine et les trioxaquines
3-1) L'artémisinine
3-2) Mécanisme
d'action de l'artémisinine
3-3) Les
trioxaquines
4) Quelques autres antipaludéens
Annexe 1 : La malaria
Annexe 2 : Hémoglobine –hème
Annexe 3 : Les pharmacophores
1) Le paludisme
L'OMS
nous apprend "qu'en 2022 on estimait à 249 millions le nombre de cas de
paludisme dans le monde et à 608 000 le nombre de décès dus à cette maladie
dans 85 pays".
C'est
en Afrique qu'on enregistre le plus grand nombre de cas (94%) et 95% des décès.
Un
peu plus de la moitié des décès sont enregistrés dans quatre pays africains :
le Nigéria(26,8%), la République démocratique du Congo (12,3%), l'Ouganda
(5,1%) et le Mozambique (4,2%). (Source OMS).
Egalement
connu sous le nom de malaria (voir annexe 1), le
paludisme est une maladie parasitaire potentiellement mortelle.
- Il existe depuis des millénaires et a été décrit
dans des textes anciens, notamment en Chine et en Égypte.
- Les premières preuves de
paludisme remontent à plus de 4 000 ans.
- Il a été reconnu
comme une maladie transmise par les moustiques (femelles du genre Anopheles)
à la fin du XIXe siècle (1898) par le médecin britannique Sir Ronald Ross (Prix Nobel de
physiologie ou médecine en 1902).
Agents
pathogènes
:
- Le paludisme est causé par
des protozoaires parasites du genre Plasmodium (le nom courant est
"hématozoaire du paludisme").
- Les espèces les plus
courantes incluent Plasmodium falciparum, Plasmodium vivax, Plasmodium
ovale et Plasmodium malariae.
- Plasmodium falciparum
et Plasmodium vivax sont les plus dangereux ; Plasmodium falciparum
est responsable de la plupart des décès dus à cette maladie.
Symptômes :
- Les symptômes du paludisme
comprennent de la fièvre, des frissons, des maux de tête, des douleurs
musculaires, de la fatigue et des vomissements.
- Dans les cas graves, il peut
entraîner des complications telles que l'anémie, des troubles neurologiques,
une insuffisance rénale, voire le décès.
Prévention
:
- La prévention du
paludisme repose sur plusieurs mesures, notamment l'utilisation de
moustiquaires imprégnées d'insecticide, l'élimination des eaux stagnantes où
les moustiques se reproduisent, et l'utilisation de médicaments prophylactiques
dans les zones à risque.
Traitements :
- Le traitement du paludisme
dépend du type de parasite impliqué et de la gravité de l'infection.
- Les médicaments
antipaludiques qui ont été ou sont actuellement utilisés comprennent entre autres, outre la quinine,
la chloroquine, l'artémisinine combinée à d'autres médicaments selon les
directives de l'Organisation mondiale de la santé (OMS).
- Dans les cas graves, une
hospitalisation et un traitement intraveineux peuvent être nécessaires.
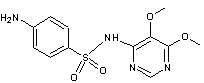
2) La
quinine
2-1) Présentation
Le
premier médicament efficace contre le paludisme a été la quinine, dérivée de
l'écorce de quinquina, un arbre originaire d'Amérique du Sud. Les peuples
indigènes utilisaient traditionnellement l'écorce de quinquina pour traiter la
fièvre. Les Européens ont découvert ses propriétés antipaludiques au XVIIe
siècle lorsqu'ils ont été exposés au paludisme en Amérique du Sud.
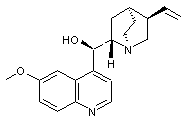
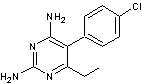
|
(-)-Quinine ou 6’-méthoxycinchonan-9-ol,
(8α,9R)
C20H24N2O2
324,417
g.mol-1 177 °C
(anhydre) 57 °C
(hydraté) Indice
de réfraction
: Pouvoir
rotatoire
: [α]28820
/°.mL.g-1.dm = -178° Densité : 1,2 IR (nombre d'onde
σ /cm-1) 3295,1621,1507,1461,
1325, 1235, 1093, 1031. Très
soluble dans l’éthanol, la pyridine ; soluble dans l’éther, le chloroforme ;
légèrement soluble dans l’eau et l’acétone. N°
CAS
: 130-95-0 |
C'est
un alcaloïde extrait de
la poudre d'écorce du quinquina rouge (dans laquelle elle est présente à
raison de 2 à 15%), Cinchona ledgeriana,
plante de la famille des rubiacées, vivant dans la cordillère des Andes à des
altitudes d'environ 2000m et actuellement cultivée en Asie. C'est Linné qui
donnera le nom Cinchona en souvenir
de la Comtesse El Cinchon épouse du vice-roi du Pérou, guérie grâce à cette
drogue) C'est
un agent antimalarique (antipaludéen). C'est
également une base utilisée pour la résolution des inverses
optiques à partir du racémique
d'un acide. Elle
est utilisée comme agent d’amertume dans certaines boissons («tonics»). |
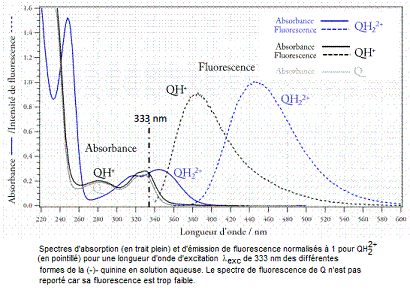
Une
solution de quinine est normalement transparente et incolore. Quand on
l'éclaire avec un laser UV, on voit la lumière bleue émise par fluorescence de
la molécule de quinine (λ fluorescence = 450 nm) sur le trajet
du faisceau UV.

Les
spectres d'absorption et d'émission de fluorescence des différentes formes de
la (-)quinine en solution aqueuse, pour une longueur d'onde d'excitation λexc=
333nm sont donnés ci-dessous :
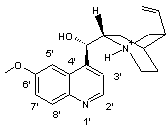
La
structure de la quinine que nous rappelons ci-dessous
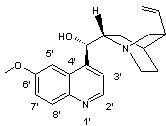
correspond
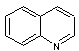
à un composé basique constitué d'hétérocycles azotés :
- l'un de type quinoléine portant un
groupement méthoxy
|
|
|
Quinoléine |
- l'autre de type quinuclidine
portant un groupement fonctionnel vinyle
|
|
|
Quinuclidine |
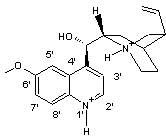
QH+
et QH22+ correspondent aux formules ci-dessous :
|
|
|
|
QH+ |
QH22+ |
2-2) Mécanisme
d'action de la quinine (d'après Anne Robert :
"Le fer de l'hème : cible pour la chimiothérapie du paludisme".
https://culturesciences.chimie.ens.fr/thematiques/chimie-organique/chimie-pharmaceutique/le-fer-de-l-heme-cible-pour-la-chimiotherapie-du).
Le
plasmodium pénètre dans les hématies où il accomplit un cycle parasitaire
responsable des symptômes du paludisme.
Le
plasmodium possède les enzymes nécessaires au fractionnement de l'hémoglobine
(voir annexe 2) en acides aminés qui lui serviront à
construire ses propres protéines.
Au
cours de cette opération, il libère le noyau hème qui possède un atome de fer.
Aussitôt libéré, le fer réduit le dioxygène en superoxyde, radical O2-*qui constitue la
première étape d'un stress oxydant fatal au parasite.
Afin
d'échapper à la toxicité engendrée par ce déchet (noyau hème) qu'il a contribué
à libérer, le plasmodium polymérise l'hème-Fe(II) en un pigment noir,
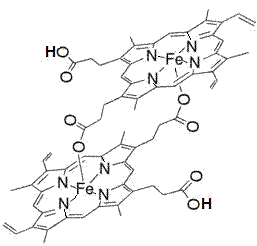
insoluble, l'hémozoïne :
|
|
Ce
dimère de l'hème ne peut plus réduire l'oxygène et n'est donc plus toxique pour
le parasite.
On
administre de la quinine ; la quinine possède, on l'a vu, un noyau quinoléine
plan qui s'interpose entre deux noyaux hème et empêche leur dimérisation en
hémozoïne ce qui permet le stress oxydant fatal au plasmodium.
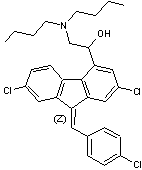
3) L'artémisine et les trioxaquines :
3-1) L'artémisinine
:
La
quinine est restée le principal traitement du paludisme pendant des siècles
jusqu'à ce que d'autres médicaments deviennent plus couramment utilisés en raison
de leur efficacité accrue et de leur meilleure tolérance.
Dans
les années 1930, on s'est aperçu qu'une résistance des agents pathogènes à la
quinine et à ses homologues apparaissait.
Au
début des années 1970, l'artémisinine est extraite des feuilles d'armoise
annuelle (Artemisia annua). En 2015, la physiologiste chinoise Youyou Tu
obtient le Prix Nobel de médecine et de physiologie (conjointement avec William
Campbell et Satachi Omura) pour sa découverte de l'efficacité de l'artémisinine
pour traiter le paludisme.
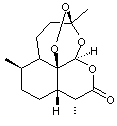
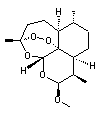
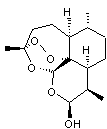
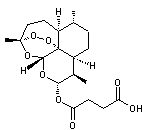
La
formule de l'artémisinine et ses principales caractéristiques sont les
suivantes :
|
C15H22O5
|
C'est
une lactone, sesquiterpénique portant un groupe peroxyde (C-O-O-C) (endoperoxyde),
dont un des nombreux stéréoisomères (la molécule présente sept carbones
asymétriques) synthétisé par l'armoise annuelle (Artemisia annua) s'est
révélé actif contre le parasite du paludisme, Plasmodium falciparum. C'est
le cycle 1,2,4-trioxane qui porte le groupe peroxyde, groupe qui entraîne
l'activité biologique de la molécule.
Industriellement
on peut obtenir cette molécule par hémisynthèse à partir de l'acide
artémisinique, lui-même fabriqué par génie génétique. |
3-2) Mécanisme
d'action de l'artémisinine : (d'après Anne Robert :
"Le fer de l'hème : cible pour la chimiothérapie du paludisme". https://culturesciences.chimie.ens.fr/thematiques/chimie-organique/chimie-pharmaceutique/le-fer-de-l-heme-cible-pour-la-chimiotherapie-du).
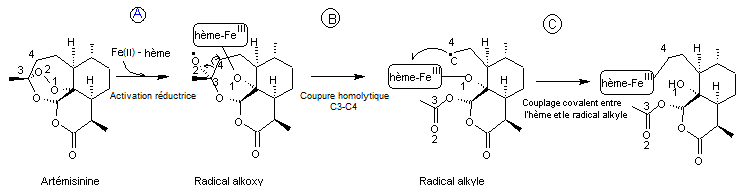
Réaction
A : Il
y a homolyse du peroxyde entre les oxygènes 1 et 2, création d'une liaison
entre l'atome d'oxygène 1 et le groupe fer--hème ; le fer passe de Fe(II) à
Fe(III). On aboutit à un radical alkoxy.
Réaction
B :
Il y a homolyse en 4 entre les carbones 3 et 4, formation d'un radical alkyle
issu de l'artémisinine.
Réaction
C :
Il y a couplage covalent entre l'hème et le radical alkyle précédemment formé.
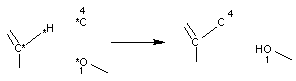
Un transfert
monoélectronique intramoléculaire réduit Fe(III) en Fe(II).
Le
composé formé correspond à
Ces
adduits ainsi formés empêchent la dimérisation de l'hème et la suite est la même
que pour la quinine, le fer conserve ses propriétés rédox qui entraînent le stress oxydant fatal au
plasmodium.
3-3) Les
trioxaquines
Dans
les années 2000, on a trouvé des parasites insensibles à l'artémisinine, et
d'autres médicaments ont été explorés.
Parmi
eux, les trioxaquines.
Ce sont de nouvelles molécules antipaludiques
hybrides à activité duale.
Elle sont l'association de deux pharmacophores (voir
annexe 3) antipaludiques de classe différente :
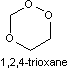
-
Un trioxane
-
Une aminoquinoléine
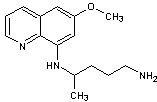
par exemple ici, la primaquine.
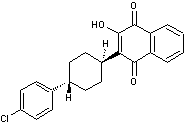
Exemple de trioxaquine :
La trioxaquine PA1259
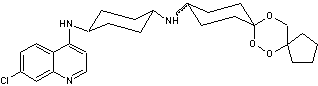
C27H36ClN3O3
Masse molaire
486,046 g.mol-1
Elle est active sur les stades larvaires et adultes
de Schistosoma mansoni.
Remarque :
L'artémisinine
molécule existant dans la nature est très voisine des trioxaquines ; elle
possède le pharmacophore trioxane qui a servi à définir cette classe de
molécules.
4) Quelques autres antipaludéens
Amodiaquine – Artéméther – Artésunate – Atovaquone – Chloroquine – Dihydroartémisinine
– Ferroquine – Halofantrine
–
Hydroxychloroquine – Luméfantrine
– Méfloquine – Pipéraquine
- Proguanil – Pyriméthamine
– Sulfadoxine.
Ils
sont classés ci-dessous par ordre croissant de l'année de leur découverte ou de
leur synthèse.
|
C18H26ClN3 Masse
molaire
: 319,872
g.mol-1 Fusion : 90°C N°
CAS
: 54-05-7 |
La chloroquine a été découverte en 1934 par
les scientifiques Hans Andersag et collaborateurs. C'est un médicament utilisé pour prévenir et traiter le paludisme,
ainsi que d'autres maladies comme le lupus et la polyarthrite rhumatoïde.
Bien qu'elle soit dérivée de la quinine, la chloroquine est produite
synthétiquement en laboratoire. |
|
C12H14N4O4S Masse
molaire
: 310,329
g.mol-1 N°
CAS
: 2447-57-6 |
C'est un antibiotique sulfamide. Comme tous les
sulfamides, il empêche la synthèse de l'acide folique (vitamine B9), intermédiaire
nécessaire à la synthèse des bases nucléiques et donc à la vie de certaines
bactéries. En association avec la pyriméthamine,
il permet de traiter certains paludismes. Cette molécule a été découverte en 1937 par
le biochimiste allemand Gerhard Domagk qui préalablement (1931) avait
découvert la sulfonamido-chrysoïdine (Prontosil®) ce qui lui valut le Prix
Nobel de physiologie et de médecine en 1939. |
|
C11H16ClN5 Masse
molaire
: 253,731
g.mol-1 Fusion : 129°C N°
CAS
: 500-92-5 |
Ce composé qui a été développé dans les années 1940,
appartient à la famille des biguanides, des molécules dérivées de la
guanidine :
Le biguanide correspond à deux molécules de
guanidine ayant un atome d'azote en commun.
Le proguanil est une prodrogue ; il est métabolisé dans le
foie en sa forme active, le cycloguanil :
|
|
C20H22ClN3O Masse
molaire
: 355,861
g.mol-1 N°
CAS
: 86-42-0 |
Amodiaquine L'amodiaquine appartient à la classe des
médicaments appelés amino-4-quinoléines. Il a été synthétisé pour la première fois en 1948
par des chercheurs français. |
|
C18H26
ClN3O Masse
molaire
: 335,872
g.mol-1 N°
CAS
: 118-42-3 |
Cette molécule est un médicament qui a été
largement étudié et utilisé dans le traitement de diverses maladies,
notamment le paludisme, la polyarthrite rhumatoïde et le lupus érythémateux. C'est un dérivé de la chloroquine. Elle a été synthétisée pour la première fois dans
les années 1950 et est devenue un traitement populaire en raison de
ses effets anti-inflammatoires. L'hydroxychloroquine interfère egalement avec les
processus cellulaires des parasites responsables du paludisme. |
|
C12H13ClN4 Masse
molaire
: 248,711
g.mol-1 Aspect : Poudre
cristalline blanche Solubilité : Insoluble
dans l'eau N°
CAS
: 58-14-0 |
Molécule découverte dans les années 1950
par des chercheurs de la société pharmaceutique britannique Wellcome Research
Laboratories (aujourd'hui GlaxoSmithKline) en tant qu'agent antipaludique. On a découvert par la suite qu'elle avait aussi
des propriétés antiparasitaires. La pyriméthamine agit en inhibant une enzyme, la
dihydrofolate réductase (DHFR) essentielle à la synthèse des folates dans les
parasites, ce qui perturbe leur métabolisme et entraîne leur mort. On l'associe souvent à la sulfadoxine
pour augmenter son efficacité. |
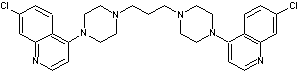
|
C29H32Cl2N6 Masse
molaire
: 535,52
g.mol-1 N°
CAS
: 4085-31-8 |
Elle a été synthétisée en France dans les années 1960. Les résistances à la chloroquine ont redonné de
l'intérêt à cette molécule. La pipéraquine tue les parasites en perturbant la
détoxification de l'hème de l'hôte. Elle empêche le parasite de dimériser
l'hème en hémozoïne. |
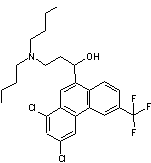
|
C26H30Cl2F3NO Masse
molaire
: 500,43
g.mol-1 N°
CAS
: 69756-53-2 |
L'halofantrine est un médicament antipaludique
appartenant à la classe des aryl aminoalcools (il possède un noyau
phénanthrène). Il a été développé par la société Geigy, aujourd'hui Novartis.
- Il est
efficace, en particulier sur les souches de Plasmodium falciparum résistantes
à la chloroquine. Son action a été remise en cause dès 1993, suite à
la découverte de sa toxicité cardiaque potentielle. |
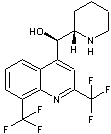
|
C17H16F6N2O Aspect : Solide
cristallisé (quand purifié dans le méthanol aqueux). Masse
molaire
: 378,311
g.mol-1 Fusion : 178,2°C N°
CAS
: 53230-10-7 |
Antipaludéen
sanguin destiné à lutter contre les protozoaires responsables du paludisme (plasmodium)
après la phase d'incubation (on les appelle alors schizontes et le médicament
est dit schizonticide). C'est
une molécule synthétique contenant le noyau quinoléine, développée dans les
années 1970 par des chercheurs de la société pharmaceutique suisse
Hoffmann-La Roche. |
|
C30H32Cl3NO Masse
molaire
: 528,940
g.mol-1 N°
CAS
: 82186-77-4 |
- La
luméfantrine est un médicament antipaludique appartenant à la classe des aryl
aminoalcools. |
|
C16H26O5 Masse
molaire
: 298,375
g.mol-1 N°
CAS
: 71963-77-4 |
C'est un méthoxyméthane semi-synthétique de
l'artémisinine. Cette molécule est plus liposoluble que
l'artémisinine. C'est un précurseur pharmacologique (prodrogue) de la dihydroartémisinine. L'artéméther a été découvert en 1971 par
des scientifiques chinois. |
|
ou DHA
C15H24O5 Masse
molaire : 284,3481
g.mol-1 N°
CAS : 71939-50-9 |
C'est un endoperoxyde, dérivé semi-synthétique de
l'artémisinine. La dihydroartémisinine est considérée comme plus stable
et possède une meilleure biodisponibilité que l'artémisinine. Peut être associée à la pipéraquine. Elle a été découverte en 1973 par des
scientifiques chinois. |
|
C19H28O8 Masse
molaire : 384,421
g.mol-1 N°
CAS : 88495-63-0 |
L'artésunate est un médicament largement utilisé
pour le traitement du paludisme, C'est un peroxyde de type sesquiterpénique dérivé
semi-synthétique, hydrosoluble, du groupe de l'artémisinine. Il est souvent associé à l'amodiaquine
ce qui augmente son efficacité. Il a été découvert en 1977 par des
scientifiques chinois. |
|
C22H19ClO3 Masse
molaire
: 366,837
g.mol-1 Solubilité : Insoluble
dans l'eau N°
CAS
: 95233-18-4 |
L'atovaquone est un médicament antipaludique et anti-protozoaire
développé dans les années 1980. Il appartient à une classe de
médicaments appelés hydroxynaphtoquinones. Utilisé principalement pour
traiter et prévenir le paludisme, l'atovaquone a également montré son
efficacité dans le traitement d'autres infections à protozoaires. L'atovaquone est utilisé souvent en association
avec le proguanil ou le proguanil-chloroquine. Il
est particulièrement efficace contre les souches de Plasmodium résistantes à
d'autres médicaments antipaludiques. Il inhibe la reproduction du parasite responsable
de la maladie. |
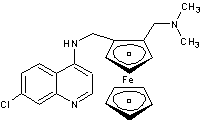
|
C23H24ClFeN3 Aspect : Solide
jaune cristallisé Masse
molaire
: 433,755
g.mol-1 Fusion : 193 à
195°C |
Antipaludique, nouveau dérivé de la chloroquine,
conçu en 1994 à l'Université de Lille 1 (Professeur Jacques Brocard). Il s'agit de l'incorporation d'un motif
ferrocénique dans le squelette de la chloroquine. Il a passé avec succès les phases I et II de
développement clinique chez Sanofi-Aventis. |
La malaria.
C'est la dénomination du paludisme dans les pays anglo-saxon.
Le mot
"malaria" signifie littéralement "mauvais air". Il fait
référence à la croyance ancienne selon laquelle le paludisme était causé par la
respiration de l'air vicié des marécages où se reproduisaient les moustiques
vecteurs de la maladie. Cette théorie a été largement répandue pendant des
siècles avant que la véritable cause de la maladie - les parasites du genre
Plasmodium transmis par les piqûres de moustiques - ne soit découverte.
Le mot
paludisme vient du latin "Palus" (marais).
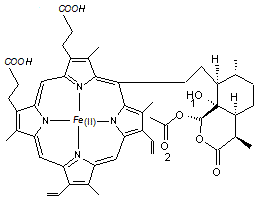
Hémoglobine –hème
Les
globules rouges ou érythrocytes donnent au sang sa couleur caractéristique. Le
colorant rouge est l’hémoglobine, en abrégé Hb.
La
partie incolore protéinique de l’hémoglobine est la globine (lat. globulus, sphère).
La
globine comporte 4 chaînes d'acides aminés, 2 chaînes a et de 2 chaînes b. Chaque chaîne est
constituée d'une hélice qui adopte une conformation spatiale lui donnant une
forme globuleuse.
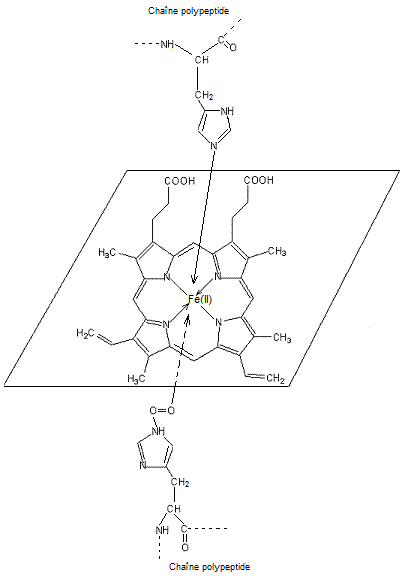
Le
groupe prosthétique (gr. prosthetos,
lié, ajouté ) est nommé hème, il s’agit d’un complexe (lat. complexus, entouré, embrassé)
fer-porphyrine ; le fer est au centre, entouré en carré par les 4 atomes
d’azote de la porphyrine (gr. porphura,
pourpre) .
Chaque
chaîne α et β de la globine possède son propre hème.
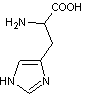
Une
molécule d'histidine, un acide aminé de la chaîne, occupe une position axiale
par rapport à l'hème et est liée au fer(II)
par sa partie imidazole.
L'autre
position axiale est d'abord occupée par une molécule d'eau ; elle est dans les
poumons remplacée par une molécule d’oxygène liée au fer et a une autre
molécule d'histidine.
|
Imidazole
Histidine
|
|
|
Hème |
Hémoglobine chargée en oxygène |
Les pharmacophores.
C'est
l'ensemble des groupes fonctionnels et leur structure spatiale nécessaires à
une molécule pour qu'elle ait des propriétés thérapeutiques données.