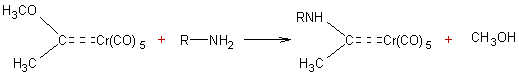CARBENES
1) Définition du carbène
– Famille des carbènes
Le carbène est une entité de
formule :CH2
électriquement neutre, dans laquelle l'atome de carbone n'a que deux liaisons
covalentes
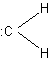
Cette molécule (carbène
"ordinaire") est la plus simple d'une série de composés : les
carbènes
Exemple :
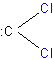 ou :CCl2 dichlorocarbène
ou :CCl2 dichlorocarbène
On peut aussi avoir la forme
![]()
cyclopropylméthylidène
2) Structure et
réactivité :
Rappel :
Un atome de carbone a six
électrons autour de son noyau dont quatre externes.
Dans la plupart des composés
organiques, un atome de carbone a quatre liaisons :
- Avec quatre atomes ou groupes d'atomes ; il est hybridé
sp3. C'est le cas par exemple du méthane :

- Avec trois atomes ou groupes d'atomes ; il est hybridé
sp2. C'est le cas par exemple de l'éthène :
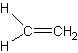
- Avec deux atomes ou groupes d'atomes ; il est hybridé
sp. C'est le cas par exemple de l'éthyne :
![]()
Dans tous ces composés le
carbone suit la règle de l'octet, les molécules correspondantes sont en général
stables.
Dans les carbènes :
L'atome de carbone ou l'un
des atomes de carbone de la molécule n'a que deux liaisons :
- avec deux atomes ou groupes d'atomes ; C'est le cas par
exemple du carbène :

- avec un atome ou groupe d'atomes ; c'est le cas par
exemple du cyclopropylméthylidène :
![]()
En considérant l'état de
spin des électrons non engagés dans les liaisons on peut distinguer deux
classes de carbènes :
v Les carbènes singulets :
Les deux électrons qui
n'interviennent pas dans les liaisons sont dans la même orbitale avec des spins antiparallèles et il reste une
orbitale p vide ; ce sont les carbènes de E.O. Fischer.
Le total des spins des deux
électrons étant 0.
L'atome de carbone est
hybridé sp2, il a une orbitale p vacante.
Les carbènes de Fischer sont
électrophiles et ceux qui sont stables le sont généralement en milieu gazeux.
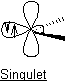
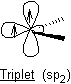
v Les carbènes triplets :
Les deux électrons qui
n'interviennent pas dans les liaisons ont des spins parallèles et occupent
chacun une orbitale :
* Structure coudée de la molécule :
* Structure linéaire de la molécule :
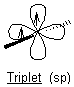
Dans les deux cas, le total
des spins des deux électrons est 1.
Ces carbènes triplets sont
des carbènes dits de Schrock ; ils sont plutôt nucléophiles se comportant
souvent comme des diradicaux et ceux qui sont stables le sont en milieu aqueux.
Après avoir été observés
comme intermédiaires réactionnels, les carbènes organiques ont été isolés sous
forme d'espèces stables, la stabilité dépendant de la nature électronique et de
la géométrie des substituants portés par le carbone carbénique.
On peut ainsi donner des
exemples de carbènes relativement stables :
(Exemples extraits de la thèse chimie moléculaire de
Céline Lyon-Saunier – 2006 – Université Paul Sabatier)
Ø Carbènes singulets :
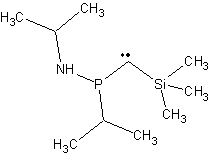
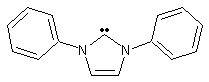
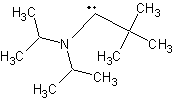
Ø Carbènes triplets :
L'angle entre les deux
liaisons du carbone carbénique est sensiblement de 180°.
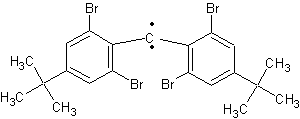
(durée de demi-vie 16s à
293K)
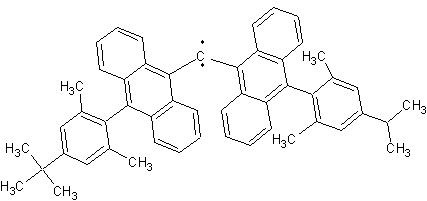
(durée de demi-vie 2
semaines à 298K)
Les carbènes sont considèrés
aujourd'hui comme des synthons
de choix.
3) Formation du carbène –
Carbènes substitués
3-1) Carbène :
La photolyse du diazométhane
H2CN2 provoque la formation du carbène et d'azote N2.
![]()
Cette espèce, est très
instable et n'existe que comme intermédiaire réactionnel.
Carbène substitué :
- Dans l'action du chlorure d'acétyle sur le
diazométhane, on obtient un carbène
substitué par le groupe acétyle.

Mais cette réaction n'est
pas la seule, on peut aussi obtenir un carbène substitué, par exemple,
- A partir d'un cétène :
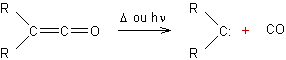
- Par α- élimination :
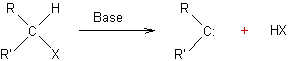
- A partir de petits cycles :
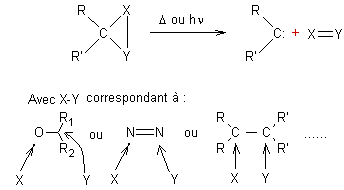
- A partir d'alcènes tendus
("encombrés") :
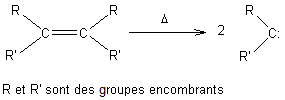
- A partir de CCl4
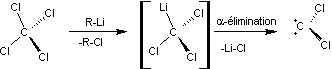
Un carbène sustitué est plus
stable que le carbène ordinaire.
3-2) Dans les réactions où intervient le trichlorométhane
(chloroforme), le dichlorocarbène est souvent un intermédiaire réactionnel.
- Ainsi le chloroforme, en présence d'une base
forte HO- engendre l'entité CCl3- puis
:CCl2 .
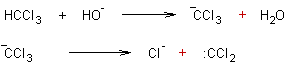
Le dichlorocarbène très
réactif réagit ensuite sur les molécules d'eau du milieu et deux réactions sont
possibles :
![]()
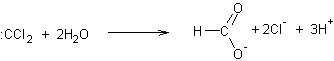
- C'est également le cas dans la réaction de
Reimer et Tiemann qui conduit, par action du chloroforme sur les phénols,
aux aldéhydes-phénols correspondants.
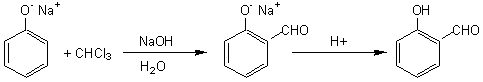
ou
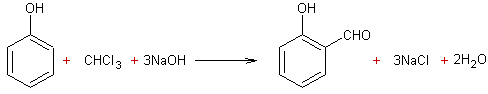
dont le mécanisme est le suivant :

- Enfin, dans la synthèse du tétrafluoroéthylène,
c'est le difluorocarbène qui est intermédiaire de la réaction :
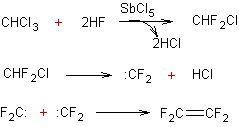
3-3) Les carbènes sont très réactifs, leur caractère électrophile les
poussant à agir sur les électrons π des doubles liaisons.
Cela peut servir de méthode
d'analyse pour les détecter ; cela sert également en synthèse :
- L'addition sur un alcène par
exemple pour donner par addition cis un dérivé du cyclopropane :
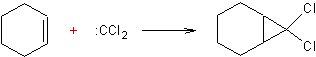
- L'insertion du carbène entre un carbone et un hydrogène
:
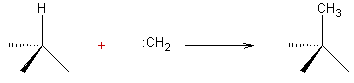
Avec le mécanisme suivant :
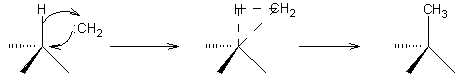
4) Formation de complexes
avec les métaux de transition.
4-1) Les carbènes peuvent participer à la constitution de
complexes avec les métaux de transition. On les appelle "métal-carbènes".
On voit encore une fois, que
la substitution stabilise les carbènes.
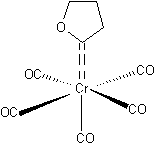
Exemple 1 : Complexe carbénique de chrome de E.O. Fischer
(1967).
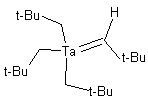
Exemple 2 : Complexe carbénique du Tantale de R. Schrock
(1974).
Ce sont des complexes de ce
genre qui ont permis de réaliser facilement des métathèses.
4-2) Rôle des complexes métal-carbène :
- Les complexes métal-carbènes sont de bons catalyseurs de métathèses des
alcènes.
On appelle métathèses des
synthèses dans lesquelles des groupements de natures comparables échangent
leurs places en conservant la structure d'origine de l'édifice.
Un cas typique :
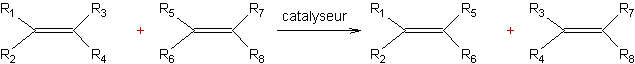
catalysé par un complexe de
métal de transition.
Ces synthèses présentent
plusieurs avantages :
v Conditions de température et
de pression très abordables.
v Moins d'étapes donc travail
plus simple, avec moins de solvants et de dégagements gazeux.
- Mais les complexes métal carbènes participent aussi en tant que
réactifs aux réactions de métathèses :
Exemple 1 :
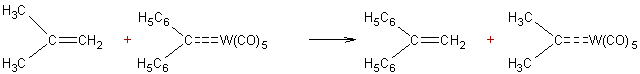
Exemple 2 :