FORMALDEHYDE
Un
polluant de l'air intérieur omniprésent.
(Gérard
GOMEZ)
1) Position du problème :
Le
formaldéhyde est aujourd'hui considéré par les autorités sanitaires françaises
comme un des polluants prioritaires à gérer (en dehors de l'amiante, du radon et
du monoxyde de carbone), du fait de son caractère cancérigène certain (d'après
le CIRC qui dépend de l'OMS) et de la fréquence de sa présence dans notre
environnement : panneaux de particules agglomérées, mousses isolantes
urée-formol, certaines moquettes, peintures au latex, adhésifs, vernis, papiers
peints, carton blanchi, certains détergents à vaisselle, des assouplissants,
certains produits cosmétiques (vernis à ongles et durcisseurs d'ongles), fumées
de foyers et de poêles à bois, fumées de cigarettes, émanations de véhicules
dans les garages adjacents…..
En
général le formaldéhyde est émis sous forme gazeuse et cette émission tend à
diminuer avec le temps et finit par cesser au bout d'une durée qui varie de
quelques semaines à quelques mois voire quelques années suivant la nature des
sources.
2) Risques encourus :
Ils
dépendent du niveau d'exposition ; on mesure ces niveaux en microgrammes de
formaldéhyde par mètre cube d'air (µg/m3) :
- Jusqu'à environ 50 µg/m3
pour une exposition de court terme (2 heures) ou 10 µg/m3 pour une
exposition de long terme, on ne distingue aucun effet critique sur la santé ;
le risque encouru est qualifié de faible.
- Entre 50 et 125 µg/m3
environ une exposition à long terme peut
causer des problèmes respiratoires comme la toux, la respiration sifflante et
une sensibilité allergique, en particulier chez les enfants ; le risque est
qualifié de moyen.
- Au-delà de 125 µg/m3
une irritation des yeux, du nez et de la gorge apparaît et à court terme les
syndromes respiratoires décrits pour une exposition moyenne à long terme
apparaissent ; il s'agit d'un risque élevé.
- Pour des concentrations très
importantes pendant de longues durées (risques professionnels pour certains
travailleurs industriels) on peut observer des cancers de la cavité nasale.
Mais ces risques ne peuvent survenir aux concentrations que l'on trouve dans la
plupart des maisons ou appartements individuels (En France la moyenne
rencontrée dans les appartements est 20 µg/m3).
On
peut assez facilement maintenir un niveau faible d'exposition au formaldéhyde
dans les habitations en renouvelant régulièrement l'air intérieur et en
réduisant le taux d'humidité car celui-ci favorise l'émission du formaldéhyde,
en entretenant les conduits de cheminées, en évitant de faire tourner un moteur
de voiture sous les fenêtres de la maison, en achetant des meubles et des
produits exempts de formaldéhyde ou des meubles dont les panneaux de particules
ont été recouverts d'un placage (plastique stratifié) ou sont pelliculés de tous
les côtés.
D'une
façon anecdotique on peut signaler que Chlorophytum
(voir image ci-dessous) dégrade le formaldéhyde.

3) Méthanal, formaldéhyde, formol
:
3-1) Propriétés :
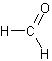
Méthanal
est en fait le nom systématique du formaldéhyde ; c'est le plus simple des
aldéhydes de formule moléculaire CH2O et de formule développée :
C'est
un gaz à odeur piquante à la température ambiante, son point d'ébullition est
-19,1°C ; il est soluble dans l'eau, une solution aqueuse à teneur en méthanal
comprise entre 30 et 50% porte le nom de formol ; le méthanal est alors entièrement sous
forme d'hydrate (gem diol ou diol géminé : CH2(OH)2)
:
![]()
sous cette forme il se polymérise lentement en
paraformaldéhyde (CH2O)n :
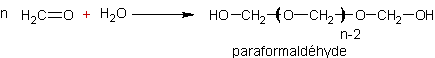
Chauffé fortement le paraformaldéhyde se
retransforme en formaldéhyde ; il constitue ainsi une source commode de
formaldéhyde gazeux.
On peut éviter cette polymérisation par addition
d'une petite quantité de méthanol.
En longues chaînes, le paraformaldéhyde
constitue un polymère, le polyoxyméthylène (POM)
très utilisé dans l'industrie automobile, l'industrie électronique, l'industrie
des sports. Son instabilité à haute température et en présence d'acides dilués
a été supprimée en modifiant les terminaisons de chaînes pour en faire des
esters ou des acétals. Il a été commercialisé pour la première fois en 1959
sous la marque Delrin par DuPont ; il présente une résistance élevée aux agents
chimiques et présente une large plage de température d'utilisation.
Le formaldéhyde est obtenu industriellement par
oxydation du méthanol à une température de 600 à 650°C en utilisant un
catalyseur à base d'argent.
En présence de dioxygène l'équation de la réaction
est :
![]()
Le méthanol provient lui-même de la synthèse :
![]()
Le mélange (CO + 2H2) appelé gaz de
synthèse est obtenu à partir du méthane.
Le formaldéhyde joue un rôle important dans la
biosynthèse de certains acides aminés.
3-2)
Utilisations :
- En agriculture : on
l'utilise
a) pour ses
propriétés antimicrobiennes (traitement anti-salmonellique) ; mis au
contact de produits alimentaires il réagit d'abord avec les amines (I) et (II)
pour donner d'une façon réversible un dérivé "N- méthylol" de l'amine
qui constitue un fongicide et possède des propriétés antimicrobiennes et
désinfectantes.
![]()
b) pour ses propriétés
de conservateur (c'est un agent d'ensilage) : On
montre que pour conserver les fourrages dans de bonnes conditions il faut
l'anaérobiose et un abaissement très
rapide du pH. L'association acide formique (abaissement du pH) et formol
(propriétés bactériostatiques qui inhibent les fermentations indésirables sans
trop modifier la fermentation lactique recherchée) s'est montrée optimale avec
2/3 d'acide et 1/3 de formol.
c)
pour ses propriétés tannantes (protection des protéines) : la forte
réactivité du formaldéhyde avec les groupements amines permet des liaisons avec
les protéines ce qui les protège de la dégradation microbienne ; c'est le
principe du tannage des protéines, qui est surtout utilisé en France pour les
tourteaux de soja, colza et tournesol.
d) le
formaldéhyde sous forme de formol est également utilisé en tant qu’auxiliaire
technologique pour la détoxication du tourteau d’arachide.
Remarque : Des études ont montré que le niveau endogène
(0,023 à 0,039 mg/L) de formaldéhyde dans le lait provenant de vaches nourries
avec des fourrages d'ensilage ou des tourteaux de soja tannés, augmentait
légèrement et qu'il en était de même dans la viande.
- Dans l'industrie
:
a) La
condensation de l'urée avec le formol;
Avec le méthanal en solution
à environ 40% (formol) l'urée conduit
à un réseau tridimensionnel serré, des résines thermodurcissables dîtes
résines urée-formol. La réaction a lieu en présence d'ammoniac ou d'hexaméthylènediamine comme
catalyseur. Le produit obtenu est visqueux ; il peut servir à l'imprégnation
des tissus ; en le faisant durcir sous pression, à chaud et en présence
d'acide, on peut en faire des verres organiques car le matériau obtenu est
transparent et infusible ; on peut également lui adjoindre des charges
(cellulose par exemple) et des pigments et procéder à des moulages (vaisselle)
; on peut aussi préparer des colles à
bois servant de liant aux particules de bois agglomérées pour former des
panneaux, et enfin on peut aussi obtenir des mousses isolantes (MIUF)
injectées pour isoler les murs des bâtiments…..
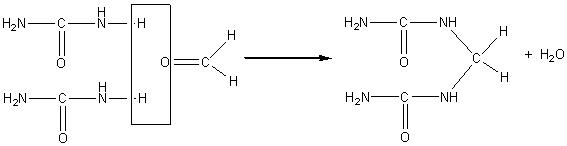
Première étape de la condensation :
puis progressivement un
réseau tridimensionnel serré :
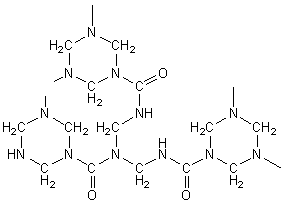
b) La condensation de la mélamine avec le formol :
La mélamine :
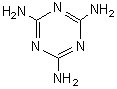
conduit aussi, par condensation avec le formol, à un réseau
tridimensionnel (polymère thermodurcissable) utilisé pour fabriquer des colles
à "durcisseur", des assiettes, des plats…
c) La
condensation de formol avec des phénols conduit également à des polymères
appelés phénoplastes et dont le plus célèbre est la bakélite. Leur
élaboration comporte trois stades A, B, C. Ils sont fluides dans l'état A,
pâteux à chaud dans l'état B, durs et infusibles dans l'état C après que les
résines aient été mélangées à des charges (poudre de bois) à des plastifiants
et des pigments puis aient été chauffées et comprimées.
Exemple: résine Benzophénol-Formol (méthanal) = bakélite (ce nom
vient de son inventeur : L.H.Baekeland
1863-1944, chimiste belge puis américain).
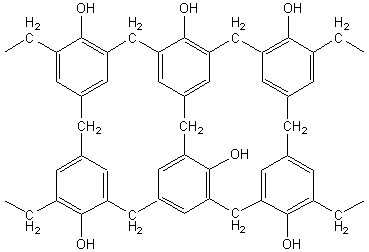
On
obtient des matières dures (plastiques thermodurcissables), de couleur sombre,
à propriétés isolantes avec lesquelles on fait des objets moulés (queues de
casseroles), des supports de circuits imprimés, des résines échangeuses de
cations (type phénoplaste sulfoné).
Globalement on
peut considérer qu'il s'agit d'une élimination d'eau entre deux cycles
benzéniques et une molécule d'aldéhyde ; l'existence de trois endroits réactifs
sur la molécule de phénol (en ortho et en para par rapport au OH) permet la
formation d'un réseau complexe tridimensionnel (résine) dont la représentation
ci-dessus n'est que partielle.
- Autres utilisations :
a) On l'utilise comme
additif alimentaire de l'alimentation humaine sous le code E 240.
b) Il sert aussi de fixateur en histologie et de conservateur de cadavres d'animaux et d'humains (thanatopraxie).
3-3) Méthodes de
détermination de la teneur en formaldéhyde de l'atmosphère :
Il existe plusieurs méthodes qui dépendent des circonstances dans lesquelles cette détermination est effectuée ; s'il s'agit de déterminer ponctuellement la teneur de l'air en formaldéhyde, lors d'un pic de pollution par exemple, on ne procède pas exactement comme lorsqu'il s'agit de déterminer une valeur moyenne, dans une pièce sur la journée.
- Prélèvement
sur cartouche imprégnée de 2,4-DNPH et analyse ultérieure :
Il
s'agit d'une méthode de référence dont le principe est le suivant (source INRS)
:
On
fait circuler l'air à analyser avec un débit qui dépend de l'importance
supposée de la teneur en formaldéhyde (0,1 à 2 L par minute) sur une cartouche
de silice imprégnée de 2,4-DNPH (tube de verre de 150mm de long et de 8 mm de
diamètre intérieur) ; Le formaldéhyde (et les autres composés carbonylés
éventuellement présents) réagit sur la 2,4-DNPH suivant l'équation :
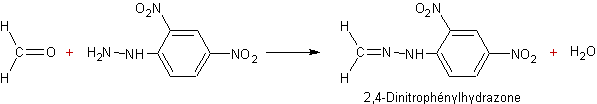
On
obtient donc (si plusieurs composés carbonylés sont présents) un ensemble
d'hydrazones qu'il convient de séparer par HPLC (Chromatographie liquide haute
performance) en éluant avec de l'acétonitrile, puis de détecter par
spectrométrie UV à 360nm. Le repérage du pic du formaldéhyde se fait par le
temps de rétention et la quantification par la surface sous le pic en se
référant à des courbes d'étalonnage réalisées préalablement.
On
peut aussi remplacer la technique de séparation par HPLC en utilisant la CPG
(Chromatographie en phase gazeuse) avec un détecteur à ionisation de flamme
éventuellement couplé à un spectromètre de masse ou avec un détecteur thermoionique.
La méthode est assez sensible et permet d'évaluer des teneurs de l'ordre de 36 µg de formaldéhyde par m3 d'air.
- Capteurs
:
La
méthode précédente, surtout si elle utilise la CPG comme moyen de détection et
de quantification reste une méthode lourde et peu utilisable sur le terrain
pour évaluer des pics de pollution. Il existe à cet effet des capteurs
chimiques ou biologiques dont nous allons donner le principe.
a) Capteurs chimiques :
Les
molécules gazeuses de formaldéhyde sont piégées sélectivement et par réaction
chimique donnent une substance changeant de couleur ou fluorescente ; la
quantification du formaldéhyde se fait alors par dosage colorimétrique ou
directement par mesure de la fluorescence.
# Le formaldéhyde peut par exemple réagir avec l'oxo-3-butanoate
d'éthyle (acétylacétate d'éthyle) :
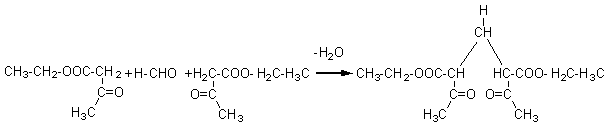
puis
condensation du composé obtenu avec l'ammoniac conduisant à une dihydropyridine
:
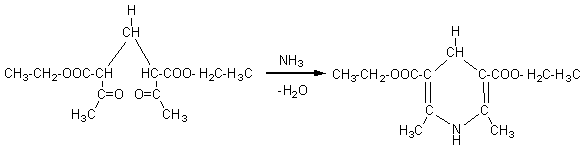
Après
oxydation de cette molécule suivie de l'hydrolyse de la fonction ester et d'une
décarboxylation :
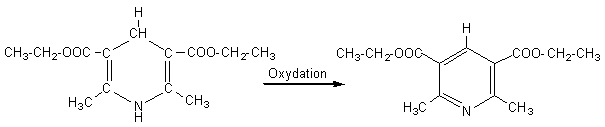
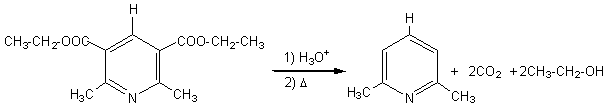
on
obtient la 2,6-diméthylpyridine ou lutidine qui est un composé
ayant une fluorescence dans le bleu. La série de réactions décrite plus haut
est appelée réaction de Hantzsch.
# Le formaldéhyde peut aussi réagir sur le fluoral-P
(4-aminopent-3-èn-2-one) :
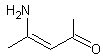
pour
donner la 3,5-diacétyl-1,4-dihydro-2,6-lutidine (DDL)
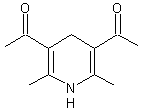
substance
fluorescente permettant la quantification du formaldéhyde par mesure
fluorimétrique ; la DDL excitée à 410 nm se désexcite par émission de
fluorescence à 510 nm.
Au
CEA de Saclay, l'équipe de Mme Thu-Hoa TRAN-THI a mis au point un capteur
Sol-Gel pulsé (xérogel, polymère poreux de silice) constituant des matrices
nanoporeuses agissant comme des éponges et dopées de fluoral-P (molécule-sonde)
qui permettent de détecter optiquement le polluant via la fluorescence du DDL.
Le
principe est l'utilisation d'enzymes pour obtenir des réactions biochimiques
spécifiques du formaldéhyde ; par exemple utilisation de la formaldéhyde
déshydrogénase (FDH) qui couplée à NAD+ oxyde le formaldéhyde en acide formique
et produit une molécule fluorescente, le NADH que l'on peut mesurer par
fluorimétrie.
D'une
façon générale ces capteurs sont moins avancés que les capteurs chimiques.