CYCLOPHANES
1)
Définition :
Un
cyclophane est un composé formé d’un grand cycle comportant en alternance,
d’une part, des systèmes cycliques ayant le nombre maximal de doubles liaisons
non contiguës et, d’autre part, des atomes ou des chaînes saturées ou non (définition officielle J.O.
du 22 septembre 2005).
En
pratique, cette définition recouvre :
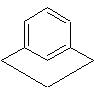
- Un noyau benzénique (aromatique)
et une chaîne aliphatique formant un pont entre deux carbones non
adjacents du noyau.
Exemple : le
bicyclo[3,3,1]nona(1,3,5)-triène
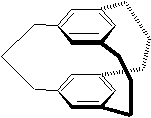
- Plusieurs noyaux aromatiques et
des chaînes aliphatiques qui les relient, l'ensemble formant un cycle ou
une "cage".
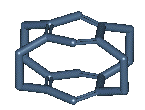
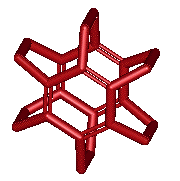
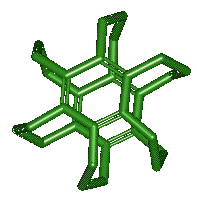
Exemple :
Remarque :
Les
chaînes formant les ponts peuvent avoir des hétéroatomes :
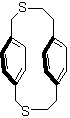 ou être dissymétriques :
ou être dissymétriques : 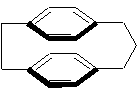
2)
Différents types de cyclophanes :
2-1) Lorsqu'un seul noyau aromatique
existe, on distingue :
- Les métacyclophanes :
la chaîne aliphatique relie deux carbones positionnés en méta sur le cycle
benzénique ; c'est le cas du premier exemple donné ci-dessus ou encore de la
molécule suivante :
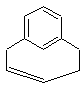
- Les paracyclophanes :
la chaîne aliphatique relie deux carbones positionnés en para sur le cycle
benzénique ; par exemple
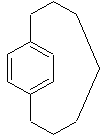
2-2) Lorsque plusieurs noyaux
aromatiques existent, on distingue :
- x
noyaux et x chaînes aliphatiques (avec x≥2) ;
v x = 2
- les
orthocyclophanes : par exemple
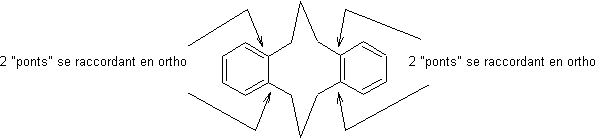
- Les méta et
paracyclophanes
Ø métacyclophane
:
par
exemple le [2,2]métacyclophane
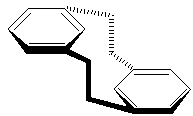 ou
ou 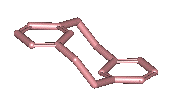
Ø paracyclophane
:
par
exemple le [2,2]paracyclophane
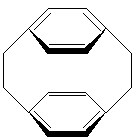 ou
ou 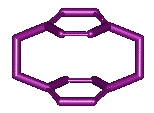
v x>2
Un
exemple :
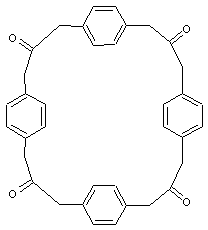
- x
noyaux et y chaînes aliphatiques (avec y>x et x≥2) ;
v x=2
|
y = 4 |
y = 6 |
y =6 |
|
|
|
|
v x>2
Un
exemple
:
2-3) Considérations géométriques
et préparation de quelques cyclophanes :
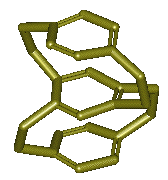
2-3-1) Le
[2,2]paracyclophane (ou PCP) :
Le
PCP est un système bicyclique très tendu ; les deux cycles ne sont pas plans et
adoptent une conformation de type bateau :

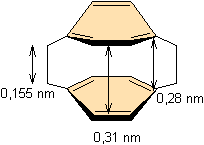
La
distance entre le plan formé par les quatre carbones centraux d'un cycle et le
plan parallèle passant par les deux autres carbones du même cycle est de 0,015
nm.
Le
caractère aromatique des cycles est bien moins marqué et ces deux cycles
s'apparentent à des molécules ayant trois liaisons doubles conjuguées.
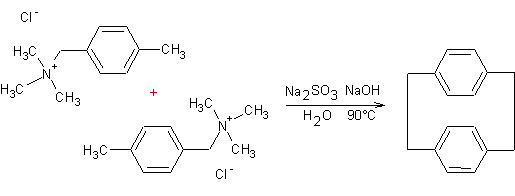
Le
PCP a été synthétisé la première fois par D.J. Cram en 1951.
Une
préparation possible de ce composé fait intervenir une élimination 1,6
d'Hofmann :
2-3-2) Les calixarènes
:
Lorsque
plusieurs cycles aromatiques reliés entre eux en méta le sont par des chaînes
constituées d'un seul carbone, on les appelle des calixarènes. Ils délimitent une cavité en forme de cône.

les
calixarènes permettent de préparer des carcérands, ensemble formé d'une cage
qui emprisonne une molécule ou un ion et l'empêche de sortir même à haute
température.
3)
Les cyclophanes et la chimie supramoléculaire :
La
chimie supramoléculaire est une branche de la chimie qui traite des systèmes
comportant deux ou plusieurs entités moléculaires organisées et maintenues
ensemble par des interactions intermoléculaires non covalentes.
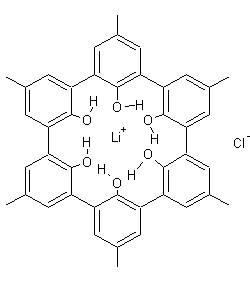
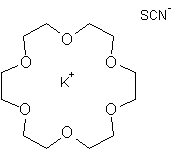
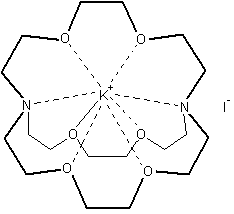
D.J.
Cram, J.M. Lehn et C.J. Pedersen reçoivent le prix Nobel de chimie en 1987 pour
leurs travaux sur, respectivement, les sphérands, les cryptates et les éthers
couronnes :
|
Un sphérand (représentation plane) et son invité (Li+) |
Un éther couronne |
Un cryptate |
|
|
|
|
Dans
toutes ces structures, une molécule (l'hôte)
reçoit en son centre un invité
(molécule, ion ou radical) qui se maintient dans cette position grâce à des
liaisons non covalentes, fortes (ioniques) ou faibles (forces de Van der Walls,
liaisons hydrogène …).
Les
grands cyclophanes, ceux qui possèdent plusieurs noyaux aromatiques,
appartiennent à ces familles hôte-invité ; ils maintiennent au centre des
cavités, grâce aux électrons π à la surface des cycles aromatiques, des
ions chargés positivement ou des molécules.
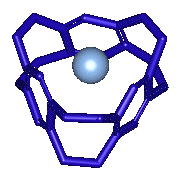
Pour
les petites structures de cyclophanes ce sont des ions, comme par exemple le deltaphane qui peut "capturer un ion argent (Ag+)
:
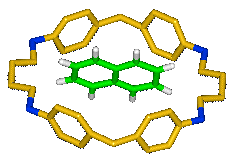
Les
grandes structures cyclophanes peuvent abriter des molécules ; c'est le cas du
cyclophane appelé CP44 qui peut abriter une molécule de
naphtalène :
De
plus grandes structures ont été synthétisées ; elles peuvent accueillir en leur
centre des stéroïdes et même le fullerène !
D'autres
captent sélectivement un ion et permettent donc de le soustraire au milieu où
il se trouve.
D'autres
encore changent de zone d'absorption des UV lorsqu'elles ont capturé un ion
donné ce qui permet la reconnaissance de cet ion.
4)
D'autres applications des cyclophanes :
Depuis
leur découverte et leur synthèse dans les années 1950, les cyclophanes ont
trouvé des applications dans des domaines aussi divers que l'optique non
linéaire, les synthèses stéréosélectives, la chimie organométallique et les
polymères conducteurs.
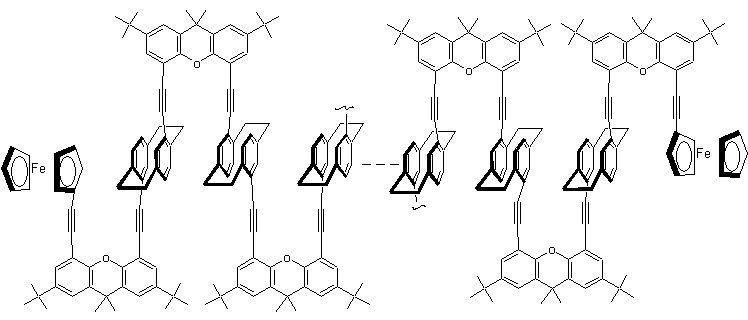
Ces
derniers sont des matériaux moléculaires susceptibles d'être incorporés dans
des circuits intégrés, des fibres optiques ou encore des capteurs. Ces
molécules sont capables de remplir les fonctions de résistances, de diodes, de
transistors ou d'interrupteurs. Un fil moléculaire conducteur a pu être élaboré
à partir d'un polymère liant le squelette d'un paracyclophane avec un dérivé du
xanthène et deux unités ferrocènes placées aux extrémités :
Bibliographie :
- La chimie supramoléculaire : Concepts et
perspectives (J.M. Lehn et André Pousse)
-
http://www.org-chem.org/yuuki/cyclophane/cp_en.html (les molécules en 3D ont été extraites de ce
site)
-
http://pages.usherbrooke.ca/ezysmancolman/image/research/Theses/MSc_thesis_Gabriel_St-Pierre.pdf
-
http://artur.univ-fcomte.fr/ST/CHIORG/these/clement_allege.pdf
- http://chem.ubbcluj.ro/~organica/abstracturi/niculina.pdf
-
http://www.ism2.univ-cezanne.fr/fichiers_pdf/enseignement/STB_SupraMol_Nov_2009_en_ligne_1.pdf