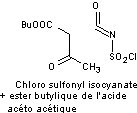EDULCORANTS
(Nature
chimique)
Jacques
BARON
Plan de
l'étude :
1. Aldoses
2. Cétoses
3. Diholosides
Saccharose, sucralose, lactose, maltose, maltitol
4. Polyols
Sorbitol, mannitol, xylitol, érythritol
5. Hétérosides
Néohespéridine
dihydrochalcone
6. Protides
Glycine, aspartame, quelques
protéines végétales
Glycyrrhizine, cyclamate, saccharine, acésulfame
Annexe 1 : Synthèse du sucralose
Annexe 2 : Synthèse de la néohespéridine dihydrochalcone
Annexe 3 : Synthèse du cyclamate
Annexe 4 : Synthèse de la saccharine
Annexe 5 : Synthèse de l'acésulfame
Un
édulcorant est une substance donnant un goût sucré. Toutefois, le mot
"édulcorant" est souvent employé dans un sens plus restreint pour
désigner une substance qui donne une saveur sucrée sans apporter de calories à
l'organisme ou qui masque le goût désagréable d'un produit en le remplaçant par
un goût sucré.
Nous
envisagerons les édulcorants au sens large.
Il existe
des édulcorants naturels et des édulcorants artificiels. Le sucre ordinaire est
le saccharose mais il existe d'autres "sucres", par exemple le
glucose.
Parmi les
édulcorants artificiels, certains sont connus de longue date (saccharine), d'autres
sont plus récents (aspartame, …).
- Il est important de distinguer
édulcorants naturels et édulcorants artificiels. Néanmoins, certaines molécules
existant à l'état naturel peuvent être obtenues par des réactions simples et
les deux produits d'origines distinctes sont utilisés. C'est le cas du sorbitol
par exemple.
Intérêt des
édulcorants artificiels :
·
Pas d'intervention dans le métabolisme glucidique
(diabétiques)
·
Acaloriques
·
Non cariogènes
·
Pouvoir sucrant intense. Il suffit de très peu de
substance pour un grand effet.
·
Coût de production rentable.
- On peut envisager une
classification mettant en jeu la puissance du pouvoir sucrant (PS).
Dans une
échelle ou le saccharose sert de référence avec la valeur PS = 1, le glucose a
un pouvoir sucrant fixé à 0,7 et pour l'aspartame, il est de 200.
Dans
l'ensemble, le pouvoir sucrant des principales substances naturelles à
considérer (glucides, polyols, …) est de l'ordre de 1.
Le pouvoir
sucrant des produits artificiels atteint facilement plusieurs centaines.
NB : Il existe une autre échelle des
pouvoirs sucrants, pour les sucres naturels : elle est basée sur un PS
égal à 100 pour le saccharose. C'est seulement pour avoir des nombres plus
maniables.
Détermination
du pouvoir sucrant :
Schématiquement,
quand on fait goûter à des spécialistes une solution de saccharose et une
solution d'édulcorant 50 fois moins concentrée, si le ressenti est le même, on
estime que le PS de l'édulcorant étudié est 50. On conçoit qu'il y ait des
écarts entre les résultats et on peut donner une valeur moyenne.
Ex : 500 à
600 fois plus sucrant que le saccharose, PS = 550.
- On peut établir une classification
chimique
Les
molécules qui entrent en jeu peuvent être des glucides ou leurs dérivés immédiats
(polyols) ou des molécules non apparentées aux glucides.
Nous
proposons une classification chimique des édulcorants comportant formule,
origine et propriétés pratiques les plus intéressantes.
1. Aldohexoses
Naturel, c'est un solide à température
ordinaire ; plusieurs représentations sont possibles pour la molécule de
glucose parmi lesquelles la forme ouverte ou la forme dite
α-D-Glucopyranose :
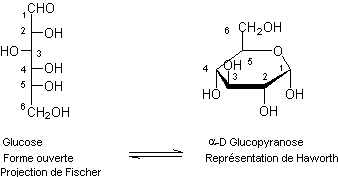
Son pouvoir sucrant est 0,7 tandis que son apport
calorique est le même que celui du saccharose ; il est très soluble dans l'eau.
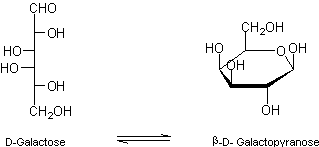
Naturel, son
pouvoir sucrant est 0,3.
Très répandu
sous forme β-D-Galactopyranose à l'état combiné : lactose, raffinose,
agar-agar, gomme de guar (galacto-mannane), …. Mais rare à l'état libre : de
petites quantités dans le miel et certains fruits.
2. Cétoses
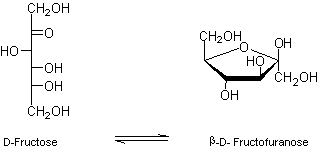
Naturel, son
pouvoir sucrant est 1,2.
Le
D-Fructose est lévogyre ; il s'est appelé jadis "lévulose" ; c'est le
sucre des fruits.
Son
assimilation par l'organisme est lente ; de ce fait, il est bien toléré par les
diabétiques.
Il apparaît
aussi par hydrolyse du saccharose (voir plus loin). Le sirop d'agave est
particulièrement riche en fructose.
Naturel, son
pouvoir sucrant est 0,8.
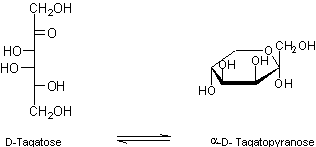
En solution,
il est essentiellement sous forme pyranose ; il est lévogyre.
Il existe naturellement
dans la plupart des produits laitiers ; il se comporte différemment du
saccharose dans l'organisme et induit une réponse glycémique moindre que
celui-ci.
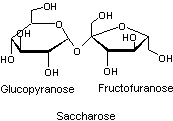
3. Diholosides
Substance
naturelle, son pouvoir sucrant est 1 par définition.
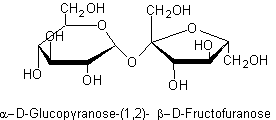
C'est le
sucre ordinaire, extrait de la canne à sucre et de la betterave à sucre.
L'usage du
sucre de canne dans le monde (Chine, Inde, Perse, ….) remonte à l'antiquité.
Outre le fait de donner un goût agréable, il a parfois servi de médicament.
D'ailleurs
au Moyen Âge, en Europe, c'est un produit très coûteux délivré par les
apothicaires.
La
production de sucre de betterave a vu le jour en Allemagne vers 1800.
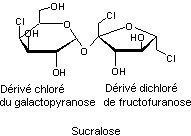
Substance
artificielle dont le pouvoir sucrant est 550.
Le sucralose
a été découvert au cours d'études sur les dérivés chlorés du saccharose et a
incité à rechercher le goût sucré dans des produits acaloriques et susceptibles
de convenir aux diabétiques.
A été sélectionnée
une molécule appelée "sucralose" pour laquelle la matière première
est le saccharose et où on remplace 3 groupements –OH par 3 atomes de chlore. A
noter cependant que la position de Cl sur le groupement pyranose en fait un
dérivé du galactose et non du glucose. Cette inversion est rappelée dans l'annexe 1 "synthèse du sucralose".
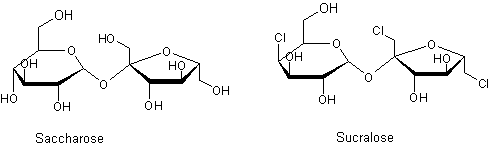
Le sucralose
est un solide très soluble dans l'eau.
Il est autorisé
en France depuis 2004 (E 950).
Il n'est pas
cariogène.
Produit
naturel au pouvoir sucrant égal à 0,3.
Un
groupement β-D-galactopyranose est condensé avec un groupement α ou
β-D-Glucopyranose.
Ainsi l'une
des formes est
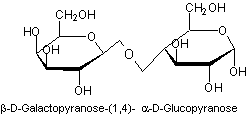
C'est le
sucre du lait des mammifères. La proportion est de 3 à 6%.
Substance
naturelle dont le pouvoir sucrant est 0,5.
Un
groupement α-D-Glucopyranose est condensé avec un groupement α ou β-D-Glucopyranose.
Ainsi l'une
des formes est
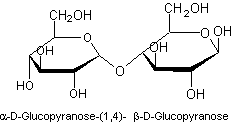
Se trouve
dans les plantes amylacées (orge, blé, maïs, ….) car il se forme à partir de
l'amidon par action d'une amylase (notamment dans l'orge germé).
Substance
artificielle au pouvoir sucrant égal à 0,8.
C'est un
dérivé immédiat de diholoside.
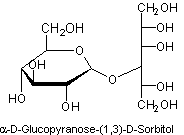
ou
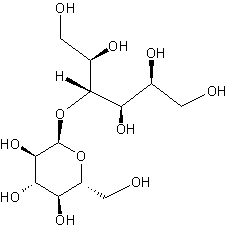
Il a un
apport énergétique de 30% moindre que celui du saccharose.
Son code
comme édulcorant est E965.
C'est un
solide à température ambiante ; il est soluble dans l'eau.
On peut
l'obtenir par hydrogénation catalytique du maltose.
4. Polyols
Composé
naturel ou artificiel ; pouvoir sucrant égal à 0,5.
On le trouve
aussi sous l'appellation "Glucitol".
C'est un hexitol.
Il s'agit du
D-Sorbitol
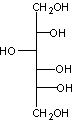
Il peut être
obtenu par réduction de la fonction aldéhyde du D-Glucose par le borohydrure de
sodium, mais il existe aussi naturellement dans les algues rouges, certaines
baies, dans les poires, les pommes, les cerises, les prunes…Son pouvoir sucrant
correspond à 50% de celui du saccharose mais il présente l'avantage par rapport
à celui-ci de ne pas favoriser les caries dentaires. Son apport énergétique est
inférieur de 30% à celui du saccharose. C'est un solide à température
habituelle. Il est très soluble dans l'eau.
Composé
naturel ou artificiel ; pouvoir sucrant égal à 0,7.
C'est un
hexitol.
Il s'agit du
D-mannitol
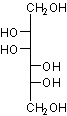
C'est un
solide à température ordinaire ; il est très soluble dans l'eau.
Son pouvoir
sucrant correspond à environ 70% de celui du saccharose avec un apport
énergétique de 55% moindre. Son caractère acide en solution, plus marqué que
celui des autres polyols fait qu'on lui adjoint souvent de l'hydrogénocarbonate
de sodium pour ajuster le pH. On le désigne comme édulcorant par le code E421.
Absorbé en quantité importante (plusieurs grammes) il a un effet laxatif.
Il est
répandu dans la nature. En Chine on l'extrait des algues. On peut l'obtenir par
hydrogénation catalytique du mannose.
Le mannitol
est aussi, souvent, incorporé aux chewing-gums.
Composé
naturel ou artificiel au pouvoir sucrant égal à 0,9.
C'est un
pentitol
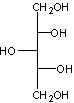
C'est un
solide à température ordinaire ; il est soluble dans l'eau.
Sa structure
à cinq carbones ne permet pas son métabolisme par les bactéries buccales mais
aussi il n'abaisse pas le pH de la salive au dessous du seuil critique qui
déclenche la dégradation de l'émail et provoque les caries. Il possède un
pouvoir sucrant correspondant à 90% de celui du saccharose, mais avec un apport
énergétique de 30% moindre.
La
production industrielle de xylitol se fait à partir de polysaccharides
(xylanes) fréquents dans la biomasse et en particulier dans certains arbres,
l'hydrolyse des xylanes conduisant au xylose, le passage du xylose au xylitol
se faisant ensuite par réduction par l'hydrogène en présence de nickel Raney ;
le bois de bouleau contient par exemple 25% de xylanes. On utilise aussi les
épis de maïs.
Les xylanes
correspondent à des unités de xylopyrannose unies entr'elles par des liaisons
glycosidiques β-1->4 ; le schéma simplifié ci-dessous montre ces
enchaînements de xylose.
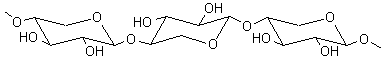
Dans les xylanes il y a aussi des substituants latéraux d'acide glucuronique et
des fonctions alcool (-OH) sont méthoxylées (transformées en –OCH3):

Le principe
est le suivant :
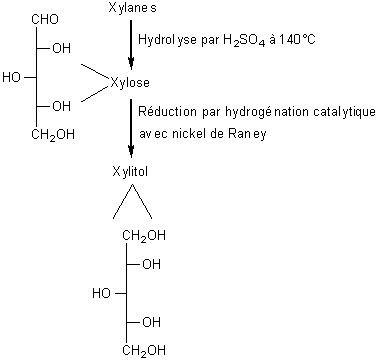
L'hydrolyse peut aussi se faire par des enzymes.
Le code du
xylitol comme édulcorant est E967.
C'est un
composé naturel au pouvoir sucrant égal à 0,7.
C'est un
tétrol.
Le produit
naturel est la forme optiquement inactive, le méso-érythritol
![]()
Il existe
dans le soja, dans certains fruits (raisin, melon…) dans certains champignons
ainsi que dans le vin. Il a un
pouvoir sucrant qui correspond à 70% de celui du saccharose, ne provoque pas de
caries et son caractère énergétique correspond seulement à 5% de celui du
sucre.
C'est un
solide à température ambiante ; il est soluble dans l'eau.
5. Hétérosides
·
Stévioside et rébaudiosides
Ce sont des
produits naturels dont le pouvoir sucrant est compris entre 300 et 400.
Considérons
la molécule de stéviol
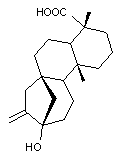
Par
condensation du stéviol avec 3 ou 4 molécules de glucose
(β-D-Glucopyranose) et intervention ponctuelle, exceptionnellement de
xylose ou de rhamnose, de différentes façons, au niveau du groupement –COOH et du
groupement –OH, on obtient le stévioside et des rébaudiosides.
En désignant
par HOOC-St-OH le stéviol, G le glucose, X le xylose, Rh le rhamnose, nous
avons
|
Stévioside |
G-OOC-St-O-G-G |
|
Rébaudioside A |
G-OOC-St-O-G-G-G |
|
Rébaudioside B |
HOOC-St-O-G-G-G |
|
Rébaudioside C |
G-OOC-St-O-G-G-Rh |
|
Rébaudioside D |
|
|
Rébaudioside E |
G-G-OOC-St-O-G-G |
|
Rébaudioside F |
|
Dans le
commerce, on parle surtout des composés majoritaires stévioside et rébaudioside
A, dont il est question plus précisément maintenant.
Le stévioside
est une molécule extraite par la vapeur d’eau, des feuilles de Stevia rebaudiana (plante originaire
d’Amérique du sud, de la famille des Asteracées).
Son pouvoir sucrant est comparable à celui de la saccharine, soit environ 300
fois supérieur à celui du saccharose. Cependant la sensation sucrée qu’il
procure est différente de celle du saccharose ou de la saccharine.
Il est
utilisé comme substitut du sucre pour les diabétiques.
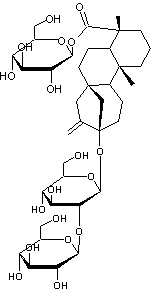
Le
rébaudioside A qui comme le stévioside n'induit pas de réponse glycémique de
l'organisme est moins amer que le stévioside et son pouvoir sucrant est
supérieur (environ 400 fois celui du saccharose) ; il possède un arrière goût
de réglisse.
·
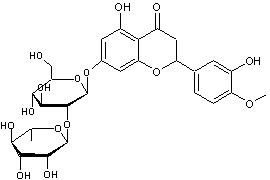
Néohespéridine dihydrochalcone (NHDC)
C'est un
composé artificiel au pouvoir sucrant égal à 1800.
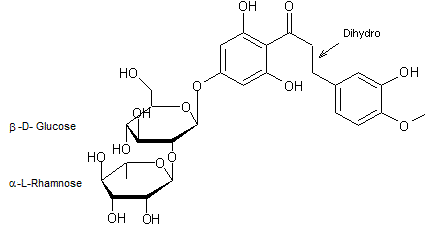
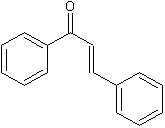
On peut
considérer que l'aglycone est un dérivé de chalcone
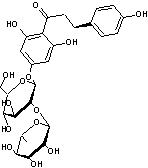
Cet
édulcorant (E959) est synthétisé à partir de la néohespéridine, un composé au
goût amer présent dans la peau des agrumes, plus spécialement le fruit du
bigaradier (orange amère).
Un composé
très voisin s'obtient à partir de la naringine extraite de la peau du
pamplemousse. C'est la naringine dihydrochalcone dont le pouvoir sucrant est de
l'ordre de 700.
Les détails
de ces synthèses figurent en annexe 2.
6. Protides
·
Glycine (anciennement glycocolle)
Produit
naturel.
C'est le
plus simple des acides aminés
![]()
Il est
sucrant et exhausteur de goût (E640)
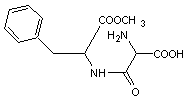
Composé
artificiel au pouvoir sucrant égal à 200. C'est un dipeptide, ester méthylique
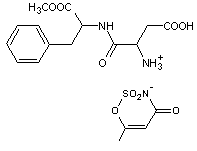
de l'aspartyl phénylalanine (Asp-Phé-OCH3)
On sait en
faire aujourd'hui une synthèse enzymatique dont le rendement atteint
pratiquement 100%.
Edulcorant
E951, son goût paraît un peu moins agréable que celui du sucre. Il est hypocalorique.
L'hydrolyse
de l'aspartame dans l'organisme libère de l'acide aspartique et de la
phénylalanine. Les sujets ne devant pas absorber de phénylalanine ne doivent
donc pas en consommer.
·
Quelques protéines végétales
Elles sont encore
plus ou moins à l'étude.
Le goût
sucré chez les protéines est une propriété inhabituelle ; le goût sucré des
fruits de certains arbres tropicaux est cependant dû à des protéines.
Exemple : la
thaumatine
Produit
naturel dont le pouvoir sucrant est environ 2000.
C'est une
protéine végétale extraite des graines du fruit d'un arbre de la forêt
tropicale africaine, le katemfé.
Pour un
édulcorant naturel, son pouvoir sucrant est très élevé.
·
Glycyrrhizine (ou acide glycyrrhizique)
Composé
naturel au pouvoir sucrant égal à 150.
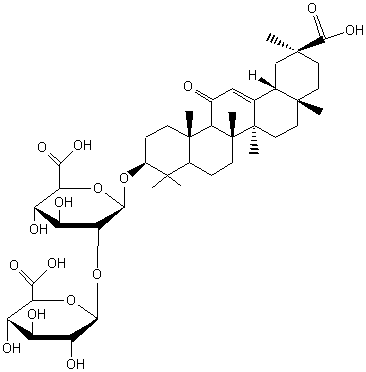
Cette
molécule fait partie de la famille des saponines.
Son aglycone
est un triterpène pentacyclique, l'acide glycyrrhétique.
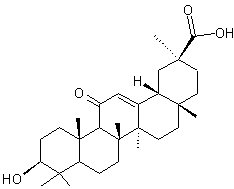
La glycyrrhizine est présente dans la racine de réglisse, une légumineuse
(ou fabacée) dont le nom botanique est Glycyrrhiza glabra (du grec
glycys = doux et rhiza = racine).
Elle est utilisée comme édulcorant (mais le goût est différent de celui du
sucre) et comme exhausteur de goût (E958).
Produit
artificiel au pouvoir sucrant égal à 40.
On peut
regrouper sous cette appellation l'acide cyclamique et ses sels de sodium, de
calcium et de potassium, avec le code des additifs alimentaires E952.
L'acide
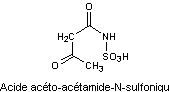
cyclamique est un dérivé de l'acide sulfamique NH2-SO3H ;
c'est l'acide cyclohexane sulfamique
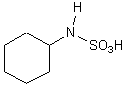
Il existe
plusieurs possibilités de synthèse (voir annexe 3).
Cette
molécule est soluble dans l'eau mais insoluble dans l'alcool.
Elle peut
s'utiliser pour les boissons non alcoolisées et les confiseries.
Le pouvoir sucrant
varie de 30 à 50 suivant les concentrations.
L'arrière
goût un peu désagréable du cyclamate fait qu'on l'associe à la saccharine, qui
a le même défaut. Il se trouve qu'alors les deux arrière-goûts disparaissent.
Produit
artificiel au pouvoir sucrant égal à 400.
La
saccharine a été découverte en 1879 par un chercheur qui travaillait sur des
dérivés de la houille. La molécule fut identifiée et donne lieu depuis à
synthèse (voir annexe 4).
C'est l'édulcorant
E954.
Cette
molécule est légèrement soluble dans l'eau ; le saccharinate de sodium, composé
ionique, est beaucoup plus soluble.
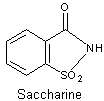
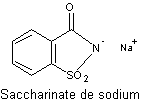
Longtemps
utilisée à la place du sucre dans le régime des diabétiques, l'usage s'est
répandu pendant la seconde guerre mondiale pour pallier la pénurie de sucre.
L'arrière-goût
un peu amer de la saccharine peut-être éliminé par association avec le
cyclamate et l'acésulfame. On emploie aujourd'hui des mélanges saccharinate +
cyclamate et saccharinate + acésulfame.
Composé
artificiel au pouvoir sucrant égal à 200.
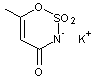
Produit
synthétique (voir synthèse en annexe 5).
C'est
l'édulcorant E950.
On le trouve
dans des confiseries, dans des sodas ….
Il améliore le
goût sucré donné par certains autres édulcorants lorsqu'il leur est associé.
D'ailleurs
on a constaté entre aspartame et acésulfame une association saline et le PS
passe de 200 pour chacun des composants à 350 pour le composé résultant.
Il existe
encore d'autres molécules édulcorantes mais elles sont beaucoup moins répandues
à l'heure actuelle pour diverses raisons : disponibilité des matières
premières, effets sur l'organisme, prix de revient, études en cours,
autorisation de mise sur le marché, ….
Citons
·
Les deux édulcorants artificiels ayant le plus fort pouvoir sucrant :
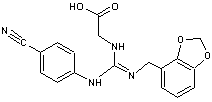
- Le lugduname ; pouvoir sucrant = 230 000
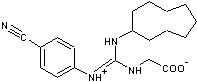
- L'acide sucrononique ; pouvoir sucrant = 200 000
·
Le néotame, l'alitame qui sont des dipeptides.
·
Des protéines végétales de fruits tropicaux déjà
évoquées : brazzéine, curculine, monélline, miraculine.
La
découverte des édulcorants artificiels a été le fruit du hasard. Aujourd'hui,
pour les synthèses, on tient compte de ce que l'on sait sur les mécanismes
stéréochimiques de la physiologie du goût.
Le goût sucré : aspect physiologique
Le mécanisme
de la sensation de goût sucré est encore controversé et fait toujours l'objet
de recherches.
La face
supérieure de la langue est couverte d'environ 10 000 papilles gustatives.
Celles qui sont sensibles au goût sucré seraient plutôt situées vers
l'extrémité de la langue pour certains, plus ou moins réparties sur toute la
surface pour d'autres.
Les points
sensibles au goût sucré sont constitués par un groupe de cellules épithéliales
en contact avec une terminaison nerveuse. Plusieurs points de vue peuvent être
considérés.
On pense a
priori pouvoir mettre en jeu la théorie clé-serrure, les papilles présentant
des formes susceptibles d'accueillir les oses et les diholosides. Mais les
molécules des édulcorants artificiels sont, elles, très diverses et sont
justement des édulcorants intenses.
Les groupes
–OH très nombreux dans les sucres formeraient des liaisons hydrogène avec les
protéines des cellules. Le glycérol a un goût sucré mais les polyholosides
(amidon, cellulose, ….) n'ont pas goût de sucre. Peut-être, ces macromolécules
n'arrivent elles pas à s'approcher suffisamment du site sensible.
Les
édulcorants artificiels ne sont pas, en général, pourvus de groupes –OH.
On peut être
surpris par la grande différence de pouvoir sucrant entre les oses et les
molécules non apparentées aux glucides. Peut-être la sensation de goût sucré
n'a-t-elle pas une cause unique et sans doute aurons-nous un jour une idée plus
précise de l'action des édulcorants.
Annexe 1 Synthèse du sucralose
La matière
première est le saccharose.
On doit
remplacer 3 –OH par 3 Cl.
Pour ce
faire, on emploie le chlorure de sulfuryle SO2Cl2 ou le
chlorure de thionyle SOCl2.
Principe de
la réaction avec SOCl2 :
R-OH + SOCl2 -> R-Cl +
SO2 + HCl
Mais il faut
protéger les autres groupements –OH par acétylation (anhydride acétique) et prévoir
leur désacétylation en fin d'opération (par NaOH ou alcoolate de sodium) le
tout dans des solvants appropriés.
Dans ces
chlorations sélectives on remarque au niveau de C4 du glucopyranose
la position du Cl qui est différente de celle qu'on pourrait attendre, ce qui
en fait un dérivé chloré du galactopyranose.
Finalement,
nous avons
Synthèse de
la néohespéridine dihydrochalcone (NHDC)
On extrait
la néohespéridine de l'écorce d'orange amère.
C'est un flavonoïde
dont la partie glucidique est un enchaînement de α-L-rhamnose et de
β-D-glucose par liaison 1,2-glycosidique.
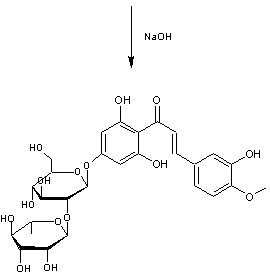
On provoque
une rupture du cycle pyranique par action de la soude puis on fait une
hydrogénation catalytique (Pd).
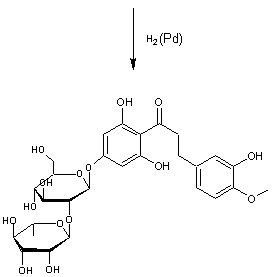
Synthèse de
la naringine dihydrochalcone
On extrait
la naringine de la peau du pamplemousse.
La formule de
la naringine ne diffère de celle de la néohespéridine que par les substituants
sur le noyau à l'extrémité opposée au groupe glucidique.
Par le
procédé qui vient d'être décrit, on obtient la naringine dihydrochalcone
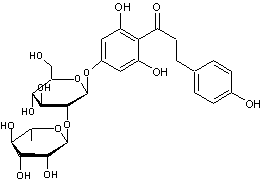
Synthèse de
l'acide cyclamique
A partir de
la cyclohexylamine
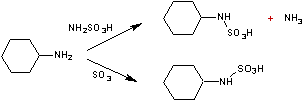
L'acide
sulfamique est obtenu par la réaction entre produits très concentrés :
NH3
+ SO3 -> NH2SO3H
La
cyclohexylamine peut-être obtenue par de nombreuses voies :
![]()
![]()
Mais ces
réactions engendrent de nombreux produits intermédiaires mélangés.
On a reconnu
qu'il vaut mieux procéder par amination réductrice de la cyclohexanone :
![]()
La
cyclohexanone peut s'obtenir par cyclisation de l'acide adipique :
![]()
ou par
oxydation du cyclohexanol
![]()
Quant au
cyclohexanol, il peut s'obtenir de deux façons :
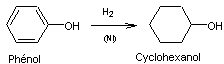
ou
hydratation du cyclohexène, lui-même issu de la deshydrogénation du cyclohexane
:
![]()
Synthèse de
la saccharine
La
saccharine a d'abord été préparée à partir du toluène
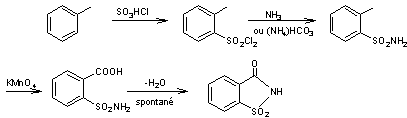
Puis on a
trouvé que le rendement est bien meilleur en utilisant l'acide anthranilique.
L'origine de ce dernier étant en principe, le naphtalène, on a la succession
d'étapes ci-après :
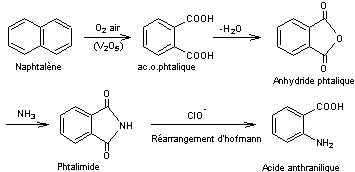
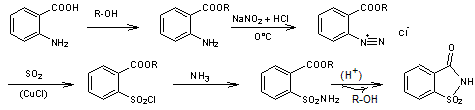
Synthèse de
l'acésulfame
Le pouvoir
sucrant de l'acésulfame a été découvert par des chercheurs utilisant des produits
à base de noyau oxathiazine et plus spécialement oxathiazinone
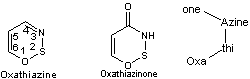
Dans la
famille de ces composés on a retenu comme étant celui qui convient le mieux, le
sel de potassium du 2,2-dioxyde de 6-méthyl 1,2,3-oxathiazin 4-one
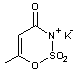
Il existe
deux synthèses possibles.
Elles
mettent en jeu des dérivés β-carbonylés d'acides carboxyliques et des
dérivésd'esters isocyaniques.
Une
disposition judicieuse de ces molécules permet de se faire une idée des
réactions de synthèse conduisant à l'acésulfame
|
1ère
méthode :
cyclisation de |
2ème
méthode :
réaction entre deux molécules
avec cyclisation |
|
|
|