ACTIVITE OPTIQUE SANS CARBONE
ASYMETRIQUE
1) Molécules d'allènes et de
spirannes
L'activité optique d'une molécule est généralement
le signe que cette molécule possède un ou plusieurs carbones asymétriques. Il
existe cependant quelques cas où l'activité optique existe sans carbone
asymétrique (atropisomères
).
C'est le cas de certains allènes, de
certains spirannes et de certains dérivés du diphényle.
C'est une entrave à la libre
rotation autour d'une liaison carbone-carbone qui donne cette propriété à
certains de ces composés (allènes, dérivés du diphényle) ; c'est la disposition
rigide dans l'espace des cycles des spirannes qui est à l'origine de leur
activité optique.
- Exemple des
allènes:

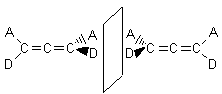
Les doubles liaisons cumulées sur
trois carbones successifs font que les groupes CAD des deux carbones terminaux
sont dans des plans perpendiculaires.De ce fait un allène du type
ADC=C=CDA où A et D sont différents peut exister sous deux formes images l'une
de l'autre dans un miroir, donc non superposables et optiquement actives ; Van't Hoff avait prévu cette
propriété pour les allènes quelques soixante années avant que l'on ait pu la
prouver expérimentalement:
- Exemple
des spirannes :
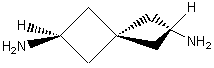
Les spirannes sont des composés bicycliques avec un atome et
un atome seulement commun aux deux cycles. Les deux cycles ne peuvent de ce fait
se trouver dans un même plan. Avec des spirannes tels que celui représenté
ci-dessous, une absence de plan de symétrie entraîne l'existence de deux
énantiomères:
- Diphényles optiquement
actifs :
C'est l'encombrement
stérique des substituants en ortho de la liaison entre les deux phényles qui
empêche la libre rotation des deux cycles autour de leur liaison commune et
entraîne l'existence de l'activité optique de la molécule:
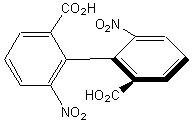
Contrairement aux allènes, ce phénomène
a été constaté expérimentalement d'abord (1922) puis interprété non sans
quelques difficultés d'ailleurs.
2) Activité optique liée à un
atome autre qu'un atome de carbone :
L'azote, le soufre, le phosphore, le
silicium et les métaux peuvent donner des molécules organiques chirales.
Pour le silicium tétravalent les
choses se passent comme pour le carbone.
Pour l'azote trivalent l'activité
optique est liée à la difficulté que présente la molécule à s'inverser. Ainsi
les amines substituées par trois groupes différents ne présentent pas
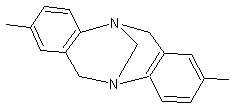
d'activité optique. Par contre la molécule suivante (appelée base de Tröger)
rigidifiée par les cycles, est optiquement active :