LES
THIOLS
R-SH
1) Introduction.
- La formule générale des thiols laisse présager des analogies avec les alcools (R-OH) car dans une molécule de thiol, un atome de soufre remplace l’atome d’oxygène de la molécule d’alcool.(O et S sont dans la même colonne de la classification périodique)
- Les thiols portent le nom de thio-alcools ou de mercaptans.
- Lorsque un atome de soufre remplace l’atome d’oxygène d’un éther-oxyde (R-O-R’) la molécule qui en résulte (R-S-R’) porte le nom de thioéther.
2) Nomenclature.
On nomme les thiols en ajoutant le suffixe thiol après le nom, ou en utilisant le préfixe sulfanyl ou thio lorsque ce substituant n’est pas prioritaire :
|
méthanethiol |
CH3SH |
|
éthane-1,2-dithiol |
HSCH2CH2SH |
|
2-thioéthan-1-ol |
HSCH2CH2OH |
Dans le cas des thioéthers,
on utilise le terme sulfure :
CH3-S-CH2CH3 sulfure d’éthyle et de méthyle
3) Préparation.
Les thiols peuvent s’obtenir par des réactions calquées sur certaines de celles qui conduisent aux alcools :
3-1) Addition de sulfure d’hydrogène sur un alcène.
Cette
réaction est analogue à l’hydratation des alcènes, elle s’effectue en présence
d’acide sulfurique et obéit à la règle de Markovnikov.
Rappel de la règle de Markovnikov :
Lors de l’addition d’un composé hydrogéné XH sur un alcène dissymétrique,
l’hydrogène se fixe sur le carbone le moins substitué (le plus hydrogéné) et
le groupe
restant sur l’autre carbone.
R-CH=CH2 + H2S → R-CHSH-CH3
3-2)
Substitution d’un dérivé halogéné.
On fait réagir de l’hydrogénosulfure de sodium (Na+ + SH-
) qui donne sur dérivé halogéné un thiol.
R-X + SH- → RSH + X-
3-3)
Réaction du soufre sur un organomagnésien.
Par action du magnésium sur un dérivé halogéné en milieu anhydre on obtient l’organomagnésien,
sur lequel on fait agir le soufre, pour obtenir finalement le thiol par hydrolyse
du produit formé.
RX + Mg → R-MgX
R-MgX + S
→ RSMgX
RSMgX + H2O
→ RSH + XMgOH
4)
Propriétés.
4-1)
Propriétés physiques.
· Odeur très désagréable, nauséabonde (Par exemple, pour se défendre le sconse projette des composés volatils comme le 3-méthylbutan-1-thiol et le E-but-2-èn-1-thiol ; l’urine des renards contient des thiols….), détectable dans l’air par l’odorat à des concentrations très faibles 1 partie pour 50 milliards. Parmi les plus notoires, citons le sulfure d'hydrogène H2S et des composés naturels comme l’allicine qui donne l’odeur alliacée de l’ail fraîchement coupé :
- Point d’ébullition très bas par rapport à l’alcool correspondant. (CH3OH téb =64,7°C ; CH3SH téb =6°C) Cette grande différence est liée à l’absence de liaisons hydrogène entre les molécules de thiols. Le soufre étant moins électronégatif que l’oxygène, la liaison S-H est moins polarisée que la liaison O-H. Cela explique aussi que les thiols soient beaucoup moins solubles dans l'eau que les alcools correspondants.
4-2) Propriétés chimiques.
a) Acidité.
· Les thiols sont nettement plus acides que les alcools. (pKa de l’ordre de 11 pour les thiols alors qu’il est supérieur à 15 pour les alcools). Cette propriété est liée à la différence de rayon entre S et H et à la longueur de liaison S-H car la différence d’électronégativité entre S et O laisse prévoir une plus grande acidité des alcools. De plus, ils sont aussi de meilleures bases de Lewis (une base de Lewis est une espèce chimique " donneuse " d’électrons).
· Les thiols donnent plus facilement des dérivés métalliques (thiolates) que les alcools.
RSH + Na → RSNa
+ ½ H2
· Les thiols réagissent avec la soude pour donner du thiolate de sodium.
RSH + NaOH = RSNa + H2O
· L’ion thiolate RS- se comporte comme un réactif nucléophile (qui recherche un site présentant un défaut d’électrons) susceptible d’effectuer des réactions de substitution :
RS- + R’-X → RSR’ + X-
Dans ce cas on obtient un thioéther.
b) Estérification.
· Elle est difficile avec les acides organiques mais facile avec les chlorure d’acyle :
R-COCl + R’SH → R-COSR’ + HCl
c) Oxydation.
L’oxydation des thiols est très différente de celle des alcools :
· Un oxydant modéré, comme le diiode conduit à un disulfure d’alkyle (principe de la coiffure permanente), parce que, contrairement à la liaison O-O (35 kcal.mol-1), la liaison S-S (65 kcalmol-1) est très stable.
2 RSH + I2 → R-S-S-R + 2 HI
Il en est de même avec l'eau oxygénée ou un
hypochlorite alcalin :
2 RSH + H2O2 → R-S-S-R + 2 H2O
· L’acide nitrique transforme les thiols en acides sulfoniques:
RSH → R-SO3H
Le groupement fonctionnel thiol et les ponts
disulfure jouent un rôle important dans divers processus biologiques. (synthèse
des protéines et des acides gras).
d) Préparations et propriété chimique des thioéthers :
La méthode de
Williamson de synthèse des éthers-oxydes est utilisable à la préparation des
des thioéthers symétriques R-S-R ou dissymétriques R-S-R' :
C2H5Br
+ -SCH3 = C2H5-S-CH3 +
Br- (Sulfure de
méthyléthyle)
2 C2H5Cl
+ S2- = C2H5-S-C2H5 + 2
Cl- (Sulfure de diéthyle)
Les
thioéthers peuvent être oxydés facilement en sulfoxydes
et en sulfones:
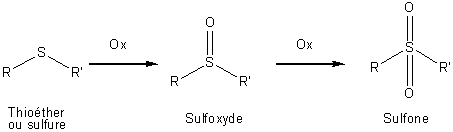
Finalement, il est à noter que de nombreux médicaments salutaires contiennent du soufre dans leur squelette moléculaire. Citons entre autres les classes d’agents bactériostatiques puissants connus sous les noms de sulfonamides ou sulfamides.