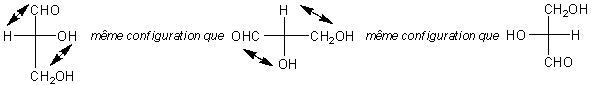
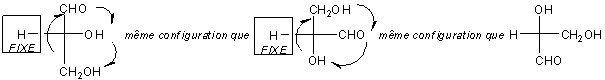
REPRESENTATION DE FISCHER
1) Objet - exemple :
Il s'agit d'un mode de représentation plane d'une
molécule possédant un ou plusieurs carbones asymétriques.
L'un des deux stéréoisomères du 2,3-dihydroxypropanal
(glycéraldéhyde ou aldéhyde glycérique) CH2OH-C*HOH-CHO se
représente ainsi :
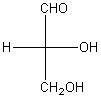
Cette représentation est surtout utilisée dans le cas
des acides aminés et des "sucres" (glucides).
2) Première règle :
Le carbone central (carbone asymétrique marqué par un
astérisque sur la formule semi-développée) occupe le point d'intersection de
deux lignes formant une croix ; les
atomes ou groupements d'atomes liés à ce carbone occupent les extrémités de la
croix.
3) Relation entre cette
représentation et la représentation de Cram
:
Dans la représentation de Fischer, par convention,
les liaisons horizontales (ici H-C et C-OH) ne sont pas dans le plan, mais
pointent vers le lecteur :
![]()
De même les liaisons verticales (C-CHO et C-CH2OH) pointent vers
l'arrière :
 Soit en réunissant les deux :
Soit en réunissant les deux :
 ce qui donne en
représentation de Cram :
ce qui donne en
représentation de Cram :
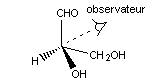
Ainsi
 analogue à
analogue à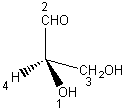
correspond
à la configuration R.
et
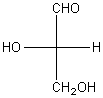 analogue à
analogue à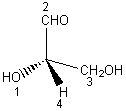
correspond à la configuration S.
4) Changement de configuration par rotation dans la
représentation de Fischer :
- Une rotation de 90° dans le
plan (autour d'un axe perpendiculaire au plan et passant par le centre de
la croix) modifie la configuration de la molécule :
 configuration R
configuration R![]() devient une molécule à configuration S
devient une molécule à configuration S 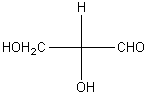
- Deux rotations successives de 90°
dans le même sens, dans le plan, conduisent donc logiquement à la même
configuration que la molécule de départ.
- Une rotation de 180° hors du
plan autour de l'axe constitué par les liaisons verticales modifie la
configuration de la molécule :
 configuration
R
configuration
R![]() devient
une molécule à configuration S
devient
une molécule à configuration S
|
COMMENT CONSERVER LA CONFIGURATION EN PERMUTANT LES ATOMES
OU GROUPES D'ATOMES?
1) Par permutation de deux paires
d'atomes ou groupes d'atomes à la fois : |
5) Cas de deux carbones
asymétriques : Les rotations apportent les mêmes changements que dans le
cas d'un seul carbone asymétrique :
- Une
rotation de 180° dans le plan (donc analogue à deux rotations de 90°
dans le même sens) ne modifie la configuration de la molécule :
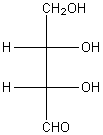 (A) a la
même configuration que (B)
(A) a la
même configuration que (B) 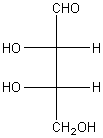
- Une
rotation de 180° hors du plan de (B) autour de l'axe constitué
par les liaisons verticales conduit à :
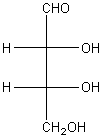 une molécule (C) énantiomère de (B).
une molécule (C) énantiomère de (B).
- Remarque : Si l'on permute les deux groupements d'une même ligne verticale de (B) :
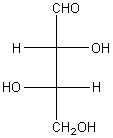 On obtient
un diastéréoisomère de (B).
On obtient
un diastéréoisomère de (B).
6) Convention :
Bien que l'on puisse faire tourner la molécule et
obtenir en conséquence plusieurs représentations, il est de règle de disposer
une molécule que l'on souhaite représenter avec la convention de Fischer, en
plaçant la chaîne principale verticale, la fonction la plus oxydée en haut (on
préfèrera par exemple (B) à (A)) :
 (B) préférable à (A)
(B) préférable à (A)
7) Configurations (D) et (L) :
7-1) Molécules
à un carbone asymétrique :
Bien que les configurations d'une molécule au niveau de tous les carbones
asymétriques qu'elle renferme puissent être parfaitement décrites par la
notation R,S, on trouve très souvent encore ces configurations désignées par
(D) ou (L).
Exemple : Examinons à nouveau la
molécule de 2,3-dihydroxypropanal :
 Configuration S ou (L).
Configuration S ou (L).
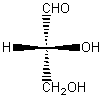
Elle est de configuration S (voir plus haut) ; on peut aussi dire qu'elle est
de configuration (L), car le OH de son carbone asymétrique est placé à gauche
dans la représentation de Fischer. Si l'on prend le stéréoisomère R de cette
molécule, il est de configuration (D) car le OH de son carbone asymétrique est
placé à droite dans la représentation de Fischer :
 Configuration R ou (D).
Configuration R ou (D).
Autre exemple : la molécule d'alanine suivante, représentée
suivant la convention de Fischer est de configuration (L) :
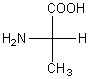 le groupement amino est à placé à
gauche.
le groupement amino est à placé à
gauche.
7-2) Molécules
à plusieurs carbones asymétriques :
La notation (D) ou (L) est surtout utilisée pour représenter les acides aminés
et les glucides. Dans ce dernier cas c'est le dernier carbone asymétrique
de la chaîne (carbone asymétrique le plus bas dans cette chaîne placée suivant
la convention de Fischer, celui donc ayant le numéro le plus grand) qui donne
sa configuration (D) ou (L) à l'ensemble de la molécule :
Ainsi cette molécule de glucose est (D) :
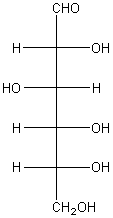 La configuration de chaque atome de
carbone asymétrique du (D)-glucose est 2R,3S,4R,5R.
La configuration de chaque atome de
carbone asymétrique du (D)-glucose est 2R,3S,4R,5R.
Et de même cette molécule de galactose est (L) :
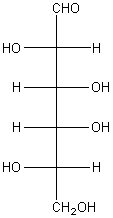
Dans le cas des acides aminés, c'est le premier
carbone asymétrique de la chaîne (carbone
asymétrique le plus haut dans cette chaîne placée suivant la convention de
Fischer, celui donc ayant le numéro le plus faible) qui donne sa configuration
(D) ou (L) à l'ensemble de la molécule :
Ainsi cette molécule de thréonine est (L) :
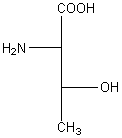
7-3) Configuration
et pouvoir rotatoire :
Une molécule dextrogyre (capable de faire tourner le plan de polarisation d'une
lumière polarisée vers la droite) est notée (+) ou (d) et une lévogyre est
notée (-) ou (l).
Il n'y a aucune relation entre les configurations (D) ou (L) d'une molécule et
son pouvoir rotatoire (d) ou (l) ; une molécule (D) peut être lévogyre et
inversement une molécule (L) peut être dextrogyre ; seule l'expérience permet
de conclure.
Ainsi le 2,3-dihydroxypropanal (D) est (+) tandis que les
2,3,4-trihydroxybutanals (D) sont (-).