EXERCICE 93
Synthèse
de la nootkatone:
La nootkatone,
sesquiterpène existant naturellement dans le
bois de cèdre d'Alaska et dans la pulpe de pamplemousse, est très utilisée dans
l'industrie des parfums.
Sa rétrosynthèse
est la suivante:

1) Précurseur 1 : la (E) pent-3-èn-2-one
1-1) Aldolisation de
l'éthanal:
On place à 20°C de l'éthanal en présence de soude diluée. On obtient après
réaction le 3-hydroxybutanal. Donner la formule
topologique du produit formé et le mécanisme de sa formation.
1-2) Condensation croisée :
1-2-1) Dans les mêmes conditions
opératoires, un mélange d'éthanal et de propanone peut conduire à plusieurs
produits, combien et lesquels (formules topologiques)?
1-2-2) Avec une méthode différente,
la réaction conduit majoritairement à un produit A de formule brute C5H10O2 .
Le spectre RMN de A présente l'allure suivante:
- doublet pour 3H à 1,2 ppm; singulet pour 3H à 2,2
ppm.
- doublet pour 2H à 2,4 ppm; singulet pour 1H à 2,6
ppm.
- multiplet pour 1H autour de 4 ppm.
Interpréter le spectre RMN et donner la structure et le nom de A.
1-3) Obtention de la pent-3-èn-2-one:
Préciser les conditions opératoires les plus favorables permettant de passer de
A à la pent-3-èn-2-one . Quel est le nom de cette transformation?
2) Précurseur 3 :
2-1) Addition de Michael :
En présence d'une solution d'éthanolate de sodium
dans l'éthanol, le malonate de diéthyle
(ou propanoate de diéthyle,
noté B) réagit sur l'acrylonitrile ou propènenitrile,
noté C) et donne par addition de Michael
un composé D.
2-1-1) Donner les formules
topologiques du malonate
de diéthyle B et de l'acrylonitrile C.
2-1-2) Donner la formule topologique
du composé D formé.
2-2) Hydrolyse exhaustive de D :
L'hydrolyse en milieu basique de D conduit après passage en milieu acide, au
composé E de formule brute C9H12O8.
2-2-1) Donner la formule topologique
de E.
2-2-2) Rappeler le mécanisme de
saponification de la fonction ester.
2-3) Décarboxylation de E :
Le chauffage de E permet de réaliser une monodécarboxylation
conduisant à F. Quelle est la structure de F?
2-4) Cyclisation de la chaîne carbonée:
L'estérification exhaustive de F par le méthanol conduit à G. Placé en présence
d'une solution de méthanolate de sodium dans le
méthanol, G évolue, entre autre, vers le composé cyclique H (précurseur 3).
Donner les formules topologiques de G et de H.
3) Passage du précurseur 3 au précurseur 2:
3-1) Méthylation de H:
H placé en milieu basique est opposé à l'iodométhane,
ce qui permet d'obtenir I de formule
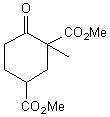
Donner un exemple de base utilisable pour cette réaction en justifiant
soigneusement la réponse.
3-2) Protection de fonction:
I est ensuite transformé en J:
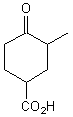
La protection de la fonction cétone de J sous forme d'acétal avec
l'éthane-1,2-diol échoue partiellement. En revanche l'action de l'éthane-1,2-dithiol (analogue soufré de l'éthane-1,2-diol) conduisant
au thioacétal K permet une protection efficace.
3-2-1) Quelle est la réaction
compétitive à la formation de l'acétal?
3-2-2) Proposer une structure pour
K.
3-3) Fonctionnalisation de la chaîne latérale:
3-3-1) On souhaite transformer la
fonction acide carboxylique de K en une cétone méthylée
pour obtenir le composé L. En notant K sous la forme RCOOH, il s'agit donc
d'effectuer la transformation ci-contre:

Alors que l'iodure de méthylmagnésium ne permet pas
de réaliser cette transformation, l'action de deux équivalents de méthyllithium suivie d'une hydrolyse en milieu acide (MeLi plus réactif que MeMgI)
est couronnée de succès.
a) Quelles réactions se produisent entre la fonction acide
carboxylique et le méthyllithium? (on appelle K' le
produit obtenu).
b) Proposer un mécanisme pour le passage de K' à L en milieu
acide.
3-3-2) Proposer une méthode
permettant de passer de L à M de formule :
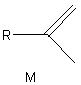
L'action d'une solution de dichloromercure(II)
dans le méthanol permet de déprotéger la fonction cétone et d'obtenir le
précurseur 2.
4) Obtention de la Nootkatone:
annellation
de Robinson:
La réaction du précurseur 2 avec la (E)-pent-3-ène-2-one (précurseur 1)
en présence d'hydrure de sodium (NaH) conduit à la Nootkatone recherchée. Sachant que l'hydrure de sodium joue
le rôle de base, proposer un mécanisme pour cette réaction.