EXERCICE 145
Extrait du Concours général - STLCLPI- 2009
Préparation de l'acétone et ses utilisations en chimie organique.
1) Présentation
L'acétone ou propanone, est le composé le plus simple
de la famille des cétones. C'est également un isomère du propanal.
1-1) Donner
la définition d'isomère. Préciser le type d'isomérie existant entre le propanal et l'acétone.
1-2)
Proposer un test chimique qui permet de différencier les deux molécules.
2) Méthodes de fabrication
2-1)
Synthèse historique
2-1-1) Ecrire l'équation de la réaction de l'acide éthanoïque avec la chaux (CaO) sachant que celle-ci se comporte comme une base forte.
2-1-2) L'éthanoate de calcium obtenu (CH3CO2)2Ca
est chauffé à forte température pour former de l'acétone et un produit minéral.
Ecrire l'équation de la réaction.
2-2) Oxydation
de l'isopropanol
L' isopropanol ou propan-2-ol
est un alcool secondaire.
2-2-1) Donner sa formule semi-développée.
Industriellement, on effectue la déshydrogénation de
l'isopropanol. Au laboratoire, on peut remplacer
cette réaction par une oxydation à l'aide du dichromate de potassium en milieu
acide, le couple mis en jeu étant Cr2O72-(aq)/Cr3+(aq).
2-2-2) Ecrire l'équation de la réaction de déshydrogénation (réaction
industrielle) de l'isopropanol.
2-2-3) Ecrire l'équation de la réaction de l'isopropanol
avec le dichromate de potassium après avoir écrit les demi-équations
électroniques (en milieu acide).
2-3) Procédé
au cumène
La synthèse s'effectue en trois étapes. Du benzène
est traité par du propène en milieu acide pour conduire au composé (A) :
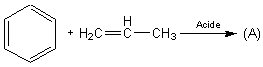
(A) réagit avec le dioxygène de l'air (le milieu est maintenu à pH>7) pour
conduire à un hydroperoxyde (B) qui se réarrange pour
former deux nouveaux produits (C) et (D) en milieu acide :
![]()
In° est un amorceur radicalaire : il favorise les réactions radicalaires. En
spectroscopie IR, (C) présente une bande large d'absorption à 3400 cm-1 .
2-3-1) Donner la formule semi-développée des composés (A), (B), (C) et (D).
2-3-2) Préciser quelle espèce intermédiaire se forme par réaction entrele propène et l'acide (on
utilisera H3O+). Justifier la réponse.
2-3-3) La réaction conduisant à (A) est une substitution électrophile
aromatique. Justifier l'utilisation des trois termes pour qualifier la
réaction.
2-3-4) Quelle information apporte un spectre I.R. ? Comment interprète-t-on la
présence d'une bande large sur le spectre I.R. de (C) ?
2-3-5) Quelle bande caractéristique est présente sur le spectre I.R. du composé
(D) ? Donner une valeur approximative du nombre d'onde associé.
2-4) Procédé Wacker-Hoechst
La réaction de synthèse de l'acétone s'effectue dans ce cas par oxydation
directe du propène par le dioxygène.
2-4-1) Ecrire l'équation de la réaction.
Pour la réaction rapportée à la stoechiométrie d'une
mole de propène et dans laquelle le propène est liquide, le dioxygène est
gazeux et l'acétone est liquide, on peut lire dans les tables : DrH° = -255kJ.mol-1 à 298 K.
2-4-2) Interpréter cette donnée.
3) L'acétone en tant que solvant
3-1) Structure électronique
3-1-1) Donner la formule de Lewis de la molécule d'acétone.
3-1-2) Représente-t-elle la structure électronique réelle de la molécule ? Si
non, expliquer ce qui n'est pas pris en compte.
3-2) Polarité
3-2-1) Représenter le moment dipolaire de la molécule.
3-2-2) Qualifier la molécule d'acétone à l'aide d'un des termes suivants :
polaire, apolaire. Justifier la réponse.
3-3) Caractère protique :
3-3-1) Donner la définition d'un solvant protique. En
donner deux exemples classiques.
3-3-2) Qualifier la molécule d'acétone à l'aide d'un des termes suivants : protique, non protique.
3-4) Solubilité dans l'eau et
application.
Un solvant organique est soluble dans l'eau si des interactions fortes entre la
molécule de solvant et la molécule d'eau peuvent s'établir.
3-4-1) Donner la formule de Lewis de la molécule d'eau.
3-4-2) Indiquer la nature de l'interaction qui s'établit entre la molécule
d'acétone et la molécule d'eau afin de justifier la très grande solubilité de
l'acétone dans l'eau.
Cette propriété est mise à profit
dans les laboratoires de chimie organique afin de sécher la verrerie. Une
verrerie contenant des traces d'eau est rincée deux fois avec de l'acétone. Un
courant d'air comprimé est envoyé sur la verrerie ce qui fait disparaître les
dernières traces d'acétone. La verrerie est alors parfaitement sèche.
On utilise cette technique pour sécher la verrerie permettant de synthétiser le
bromure de méthylmagnésium.
3-4-3) Proposer une méthode de synthèse de cet organomagnésien. Ecrire
l'équation de réaction.
3-4-4) Expliquer pourquoi la verrerie doit être parfaitement sèche. Justifier
par l'écriture d'une équation de réaction.
4) Un exemple d'application de l'acétone en chimie fine.
Le linalol
est un composé utilisé en parfumerie en remplacement de l'huile essentielle de
lavande ou de bergamote, car son odeur est assez voisine de ces deux essences.
Sa formule semi-développée est donnée ci-dessous :
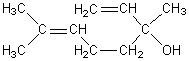
4-1) Etude stéréochimique de la
molécule :
4-1-1) Identifier le(s) atome(s) de carbone asymétrique que possède le linalol.
4-1-2) Combien de stéréoisomère(s) de configuration
possède le linalol ?
4-1-3) Représenter le stéréoisomère de configuration
(S) en réprésentation de Cram.
Justifier la réponse.
4-2) Etude de la synthèse :
Une synthèse du linalol utilise l'acétone en tant que
produit de départ.
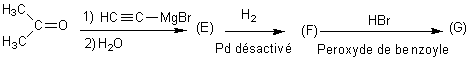
L'hydrogénation sur palladium désactivé permet de
transformer une triple liaison carbone-carbone en une double liaison C=C.
Une suite de réactions permet de passer de (I) à
l'organomagnésien (J) :
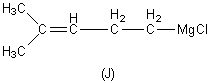
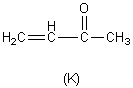
La réaction de (J) avec (K) fournit le linalol après hydrolyse.
4-2-1) Donner la formule semi-développée des composés (E) à (I).
4-2-2) Proposer un mécanisme simplifié de la réaction conduisant à (E).
4-2-3) Lors de la dernière réaction, identifier l'atome de carbone de (K) qui
subit l'attaque de l'organomagnésien de manière à former le linalol.
4-2-4) Donner les deux formes mésomères de la cétone conjuguée (K).
4-2-5) Lors de la dernière réaction, un composé se forme en plus du linalol. Identifier l'atome de carbone de (K) qui subit
l'attaque de l'organomagnésien de manière à former ce nouveau produit sachant
qu'un organomagnésien attaque les sites pauvres en électrons.
5)Applications de l'acétone en chimie industrielle
5-1) Synthèse
du bisphénol A noté BPA
Le bisphénol A, dont la formule est donnée
ci-dessous, est obtenu par réaction entre deux équivalents de phénol et un équivalent
d'acétone.
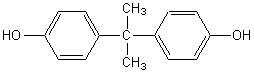
Il est utilisé à l'heure actuelle comme monomère pour la fabrication
industrielle de polymères de type polycarbonate
et de résines époxy.
5-1-1) Le phénol est-il un composé aromatique ? Justifier la réponse.
L'acétone, en milieu acide, se protone et donne
intermédiairement une espèce électrophile (L) qui réagit rapidement avec le
phénol pour conduire à (M) de formule semi-développée :
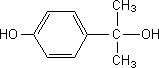
5-1-2)
Donner la structure de l'espèce électrophile (L) et donner en deux formes
mésomères.
5-1-3) Ecrire l'équation de réaction conduisant à (M). Le produit (M) ainsi
formé, en milieu acide, perd une molécule d'eau et fournit intermédiairement un
carbocation.
5-1-4) Donner la formule semi-développée du carbocation formé et justifier sa
relative stabilité.
5-1-5) Ecrire l'équation de réaction entre le phénol et (M) conduisant au
bisphénol A.
5-1-6) Justifier l'orientation de la substitution électrophile aromatique sur
le noyau benzénique du phénol intervenant au cours des deux réactions.
5-2) Synthèse de la MIBC
La MIBC, ou méthylisobutylcétone, possède la formule
semi-développée :
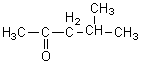
5-2-1) Indiquer le nom de la MIBC en utilisant les règles
de la nomenclature officielle.
La première étape de la réaction est une cétolisation de l'acétone catalysée par une base en phase
liquide et conduisant au composé (N). Elle est suivie d'une crotonisation
qui permet l'obtention du produit final (O). Les deux réactions se font dans le
même milieu réactionnel.
5-2-2) Ecrire l'équation de la réaction de cétolisation
fournissant le composé (N).
5-2-3) Proposer un mécanisme pour le réaction de cétolisation en utilisant les ions hydroxyde (HO-)
en tant que base.
5-2-4) Rappeler les caractéristiques thermodynamiques et cinétique de la
réaction de cétolisation.
5-2-5) Cependant, (O) est obtenu avec un bon rendement. Proposer une
explication.
La deuxième étape est une réaction d'hydrogénation du
produit (N) pour conduire à la MIBC.
5-2-6) Proposer des conditions opératoires pour réaliser cette réaction
(réactif, catalyseur, chauffage éventuel). On évoquera la nécessité de
contrôler au mieux la régiosélectivité.