EXERCICE 12
L'analyse organique d'un composé (A) CxHyOz
a donné les résultats suivants (composition massique):
% de
carbone
64,86
%
d'hydrogène
13,51
densité d de vapeur par rapport à l'air 2,55
1-1) Déterminer la formule brute de A
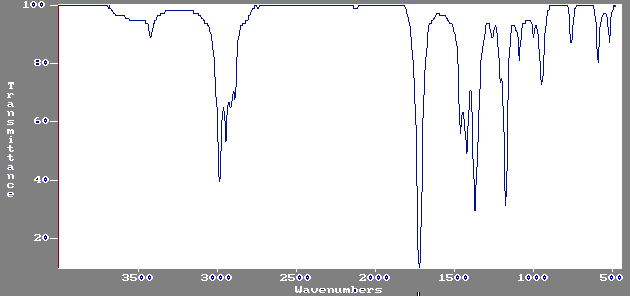
1-2) Le spectre I.R. de A est
fourni en annexe 1.
1-2-1) Pouvez-vous, à partir de ce spectre, identifier la fonction présente
dans la molécule de A?
1-2-2) Ecrire les quatre formules semi-développées possibles pour A et donner
les noms des isomères correspondants.
1-3) Sachant que la molécule de A
présente un centre de chiralité.
1-3-1) Donner sa formule semi-développée.
1-3-2) Représenter en perspective de Cram les deux énantiomères en précisant pour chacun, la
configuration absolue
R ou S. Justifier la réponse.
1-4) Le composé A est oxydé par
le mélange sulfochromique en un produit B.
1-4-1) Ce composé B donne un précipité avec la 2,4-DNPH ainsi qu'avec le diiode en milieu alcalin.
Comment ces réactions permettent-elles d'obtenir la structure de B? Nommer B.
1-4-2) Ecrire l'équation chimique de la réaction d'oxydation de A en B.
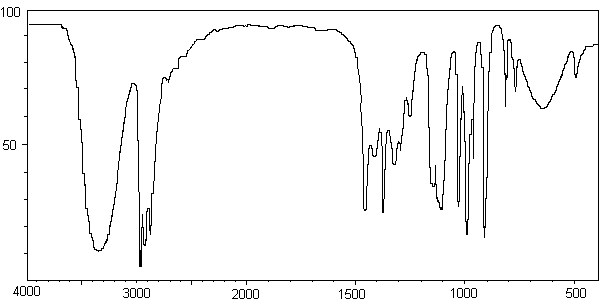
1-5) On donne en annexe 2, le spectre IR du produit B obtenu.Permet-il
de confirmer la structure de B? Justifier.
1-6) Ce produit B réagit mole à
mole avec le benzaldéhyde en milieu
basique à chaud. On obtient deux produits C et C' de même formule brute C11H12O.
1-6-1) Comment appelle-t-on les deux réactions successives qui conduisent à la
synthèse de C et de C'?
1-6-2) Donner la formule semi-développée de C et celle de C'.
1-7) Le produit B est traité par du bromure d'éthylmagnésium dans l'éther anhydre. On obtient le produit D, qui est ensuite hydrolysé pour donner un produit E. Ecrire les équations chimiques correspondantes; donner la formule semi-développée de E.
Données:
masses molaires atomiques en g.mol-1 : MO = 16,0 ;
MC = 12,0 ;MH
= 1,0.
On rappelle la relation donnant la masse molaire d'un gaz : M = 29 d.
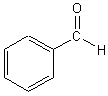
formule du benzaldéhyde:
Spectre IR du
produit A
Spectre IR du
produit B