ETUDE
CHIMIQUE DE QUELQUES STRATEGIES THERAPEUTIQUES
DANS
LE TRAITEMENT DES CANCERS
D'après le sujet de l'Agrégation de Chimie 2019.
Plan de l'étude :
1) Généralités
2) Autour des cellules - Quelques cibles thérapeutiques
3) Mode
d’action de quelques molécules sur ces cibles
3-1) Les agents alkylants
3-2) Les antimitotiques
3-2-1)
Les antipolymérisants
3-2-2)
Les stabilisants du fuseau mitotique
Annexe 1 Biosynthèse des protéines
Annexe 2 Le cisplatine
Annexe 3 Microtubule et tubuline
Annexe 4 Délétions et modifications
épigénétiques
1) Généralités :
Les
cancers sont des pathologies dont les principales origines sont des altérations
de l’ADN, support de l’information génétique. Ces altérations sont dues à des
facteurs internes (mutations, additions ou délétions (voir annexe
4) au niveau de la séquence d’ADN, modifications épigénétiques (voir annexe 4)) ou à des facteurs externes (virus, bactéries,
agents chimiques ou radioactifs, radiations électromagnétiques). La plupart des
modifications de l'ADN des cellules passent inaperçues car les systèmes de
réparation de l’ADN peuvent en corriger les défauts. Mais, dans de rares cas,
une mutation peut subsister et modifier l’expression de facteurs qui contrôlent
la prolifération cellulaire. La chimiothérapie a pour but d’enrayer ou de
ralentir l’évolution de la prolifération des cellules tumorales en agissant sur
l’ADN, l’ARN, ou les protéines de ces cellules.
L'article
porte sur l’étude de quelques stratégies thérapeutiques dans le traitement des
cancers par chimiothérapie.
Une
première partie aborde l’étude de la structure de quelques cibles biologiques
présentes dans les cellules - ADN et ARN, protéines- visées par les
chimiothérapies.
Une
seconde partie étudie plus précisément le mode d’action de quelques molécules
sur ces cibles.
2) Autour des cellules - Quelques cibles thérapeutiques (ADN,
ARN, Protéines)
Au sein
des cellules se trouve l’ensemble des gènes contenus dans une macromolécule en
forme de double hélice, l’ADN. L’ADN contient toutes les informations
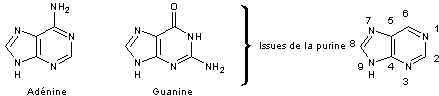
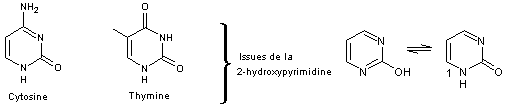
permettant à un organisme de vivre et de se développer. En 1928, Phoebus Levene un biochimiste américain d'origine lituanienne
puis Erwin Chargaff un biochimiste autrichien naturalisé américain, déterminent
la structure chimique d’un brin de l’ADN avec sa composition en bases azotées
puriques (adénine et guanine) et
pyrimidiques (cytosine et thymine).
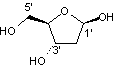
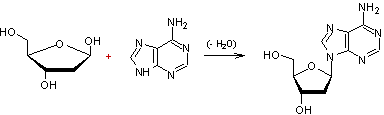
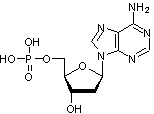
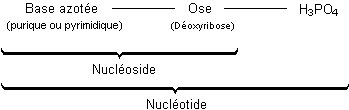
L’ADN est une macromolécule constituée d’un
grand nombre de nucléotides. Chaque nucléotide est composé d’un nucléoside lié
à un groupe phosphate et chaque nucléoside est constitué d’un aldopentose, le D
2-déoxyribose
|
|
|
lié par
son carbone anomère (1') à l’atome d’azote d’une des quatre bases azotées,
atome numéroté 1 sur les bases pyrimidiques et 9 sur les bases puriques (voir
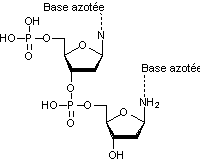
les formules qui viennent d'être données). Les nucléotides sont reliés entre
eux par des liaisons phosphodiester entre le groupe phosphate positionné en 5’
sur l’un des nucléotides et le groupe hydroxy en position 3’ d’un autre
nucléotide.
Exemple
de nucléoside avec l'adénine
Exemple de nucléotide avec l'adénine
Enchaînement de nucléotides
Schématiquement :
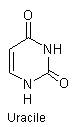
L’ARN est
constitué de chaînes beaucoup plus courtes que l’ADN, et diffère de celui-ci par
la nature du fragment glucidique (le ribose au lieu du 2-déoxyribose) et par le
fait que la thymine est remplacée par l’uracile :
En 1952, James Watson
et Francis Crick établissent la structure en double hélice de l’ADN qui leur
vaut le prix Nobel de physiologie et de médecine en 1962.
L’ADN
est constitué de deux brins qui s’enroulent l’un autour de l’autre de manière
très précise en une double hélice. Ils sont maintenus solidaires grâce à la
formation de paires de bases : l’adénine se lie de manière réversible avec la
thymine – et seulement avec elle – et la cytosine se lie avec la guanine– et seulement
avec elle.

La
molécule d’ADN, à travers plusieurs étapes, conduit à la synthèse de protéines.
Ces étapes sont les suivantes : une séquence d’ADN (un gène) est transcrite en
un ARN messager, lequel est traduit en une protéine. Les protéines ainsi
produites par l’organisme jouent des rôles physiologiques divers : rôle
structural (membranes des cellules, etc.), rôle d’usine chimique (les enzymes)
avec la biosynthèse de molécules indispensables à la vie (glucides, lipides,
acides nucléiques), rôle de messagers (hormones), etc.
Les
protéines sont des macromolécules constituées d’un assemblage d’acides a-aminés naturels de
configuration L reliés entre eux par des liaisons peptidiques. La structure
primaire d’une protéine est le fruit de la traduction de l’ARN messager par le
ribosome et correspond à l’enchaînement des acides aminés. Ces protéines
présentent aussi des structures secondaires et tertiaires (voir annexe 1).
3) Mode d’action de quelques molécules sur ces cibles :
Par
définition, le cycle cellulaire est l'ensemble des étapes qui constituent et
délimitent la vie d’une cellule eucaryote, depuis sa formation jusqu’à sa
division en deux cellules filles. Les espèces chimiques utilisées en
chimiothérapie dépendent de la cible thérapeutique visée et de la phase du
cycle cellulaire ciblée.
Dans
cette partie, nous étudierons deux types de molécules utilisées en
chimiothérapie, les agents alkylants et les poisons du fuseau mitotique.
3-1) Les agents
alkylants
Les
agents alkylants forment des liaisons covalentes avec les bases de l’ADN,
principalement au niveau des atomes d’azote des bases puriques et plus
particulièrement au niveau des guanines et adénines de l’ADN. Le chlorméthine
par exemple agit par formation d'un ion carbonium extrêmement réactif qui se
fixe surtout sur les résidus guanine de l'ADN, en position N-7 (site
nucléophile) en donnant des liaisons très stables.
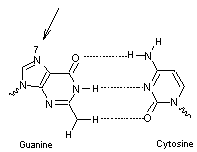
Ces
liaisons empêchent la réplication cellulaire en induisant des défauts dans la
structure de la double hélice. Si la cellule ne dispose pas de mécanismes de
réparation de l’ADN, ces altérations entraînent la mort de la cellule (apoptose).
Quelques
exemples d'agents alkylants :
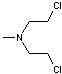
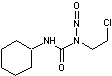
- Les moutardes
à l'azote :
Certains
de ces agents alkylants sont désignés par le terme générique «moutarde à l’azote»
car ce sont des molécules qui dérivent du "gaz moutarde" (ou
ypérite), le sulfure de 2,2'-dichlorodiéthyle
![]()
par
remplacement de l'atome de soufre par un groupement azoté, H3C-N par
exemple pour le chlorméthine.
|
Cyclophosphamide |
||
|
|
|
|
|
C'est
le premier agent alkylant à avoir été utilisé*. |
Il
s'agit d'une prodrogue ; elle doit
être métabolisée pour pouvoir exercer son action antitumorale. |
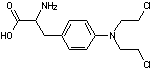
Ou
4-[bis(chloroéthyl)amino]phénylalanine Cette
molécule se fixe sur les atomes d'azote des bases puriques guanines. |
- Un autre exemple
d’agent alkylant est le cis-platine. C'est un
complexe de coordination, le Cis-PtCl2(NH3)2
de l'ion Pt(II) ; son nom : Cis-DiammineDichloroPlatine (II) ou CDDP qui s'écrit le plus souvent.en un
seul mot : cisplatine.
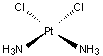
Les
deux atomes de chlore sont voisins, contrairement au composé trans où ils sont
opposés :
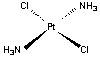
C'est
un agent alkylant de l'ADN qui se fixe sélectivement sur les bases puriques A
(Adénine) et G (Guanine), mais principalement en position N-7 de la guanine :
De
nombreuses études ont porté sur le mécanisme d’action du cisplatine comme agent
alkylant. Il a tout d’abord été montré que le complexe reste dans son état
neutre tant qu’il circule dans les voies sanguines ; la concentration en ions
chlorure y étant relativement élevée (100 mmol.L-1), elle empêche
l’hydrolyse du complexe. Le cisplatine pénètre ensuite dans la cellule par
diffusion passive à travers la membrane. La diminution de la concentration en
ions chlorure (dans la cellule elle est de l’ordre de 1 mmol.L-1) favorise
alors l’hydrolyse du cisplatine pour former des complexes électrophiles très
réactifs qui peuvent réagir avec divers nucléophiles cellulaires, comme l’ADN.
L’établissement de ces liaisons avec l’ADN double brin donne lieu à différents
adduits :


La
chélation sur un seul brin étant majoritaire.
La
fixation non chélatante par coordination à une seule guanine peut aussi avoir
lieu :
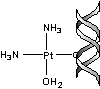
Une
telle action n'est pas observée avec le composé trans.
Un
complément d'information sur le cisplatine est donné à l'annexe
2.
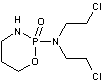
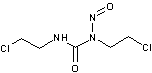
- Les nitroso-urées :
Les
nitroso-urées constituent une autre famille d'agents alkylants
|
Carmustine |
|
|
|
|
|
Sa
grande solubilité dans les graisses favorise son passage à travers la
barrière hémato-encéphalique. |
En
plus d'agir par alkylation de l'ADN et de l'ARN, elle agit par carbamylation
des protéines. |
3-2) Les
antimitotiques :
Les
antimitotiques sont des poisons du fuseau mitotique qui agissent pendant la
mitose. Au cours de cette phase, un fuseau formé par des microtubules (voir annexe 3) est constitué. Les chromosomes dédoublés migrent
le long de ce fuseau vers chaque extrémité des microtubules. Les antimitotiques
altèrent ces microtubules, forme polymérisée de la tubuline, ce qui bloque la
prolifération cellulaire.
Ils
sont classés en deux catégories distinctes :
- les antipolymérisants qui
empêchent la polymérisation de la tubuline en microtubules et
- les stabilisants qui inhibent la
dépolymérisation de ces microtubules.
3-2-1)
Les antipolymérisants :
Les
vinca-alcaloïdes sont des poisons du fuseau mitotique qui se lient à la
tubuline, la protéine microtubulaire et empêchent la polymérisation de
celle-ci.
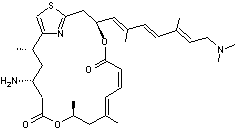
Les
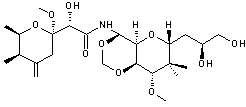
principaux étant la vincristine et la vinblastine :
|
La Vincristine |
La Vinblastine |
|
|
|
|
On peut
l’extraire de la pervenche de Madagascar (Catharanthus roseus) C'est le
principe actif d'un médicament commercialisé sous le nom Oncovin ® et utilisé
en chimiothérapie. Cette molécule se montre active notamment dans les leucémies aiguës
de l’enfant. |
Cette
molécule découverte en 1958 par deux américains, R.Noble et C. Beer peut être
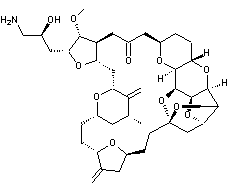
extraite de la pervenche de Madagascar (Catharanthus roseus). Elle est active dans le traitement de la
maladie de Hodgkin. L'un
des dérivés de cette molécule, le 5'-nor anhydrovinblastine ou
3',4'-didéhydro-4'-dioxy-c' novincaleucoblastine est un anticancéreux (cancer
du poumon « non à petites cellules » et cancer du sein) commercialisé sous le
nom Navelbine ® ; il a été mis au point en 1978 par le Professeur Pierre
Potier et son équipe de Gif-sur-Yvette. |
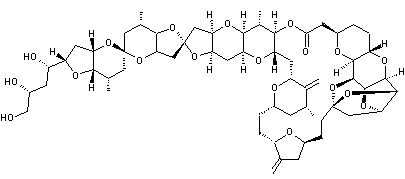
D'autres
composés agissent comme les vinca-alcaloïdes, c'est le cas de l'éribuline par
exemple, une cétone macrocyclique synthétique analogue du macrolide
halichondrine B isolé en 1986 à partir de l'éponge Halichondria okadaï
que l'on trouve sur les côtes japonaises. L'éribuline est utilisée depuis 2010
aux USA contre le cancer du sein.
|
Halichondrine B |
|
|
|
|
3-2-2)
Les stabilisants du fuseau mitotique :
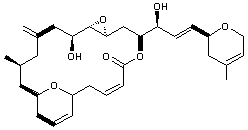
Le
Taxol® et la laulimalide, sont des molécules qui stabilisent le fuseau
mitotique en interférant sur la dépolymérisation des microtubules à l’échelle
du nanomolaire.
|
Paclitaxel ou Taxol® |
Laulimalide |
|
|
|
L’écosystème
des océans représente une source importante de molécules à fort intérêt
biologique.
En
2000, un spécimen d’éponges Mycales a fait l’objet d’une étude par Northcote.
Un échantillon congelé (170 g) de cette éponge a permis l’extraction de trois
composés aux caractéristiques structurales et aux propriétés biologiques très
différentes : 11,7 mg de pateamine, 10,6 mg de mycalamide A et 3 mg de
péloruside A :
|
Mycalamide A |
Péloruside A |
|
|
|
|
|
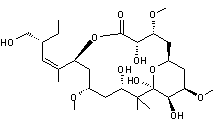
Northcote
porte son attention sur le péloruside A dont des tests ont révélé une activité
cytotoxique puissante, sans pour autant établir son mécanisme d’action. Il
s’est particulièrement intéressé à l’élucidation de sa structure.
En
2002, Miller a effectué une étude comparative entre le péloruside A, sa forme
réduite, et le Taxol®, antimitotique de référence. A l’équilibre, le péloruside
A existe sous deux formes ouverte et fermée du cycle pyrane. La réduction de ce
cycle donne un alcool en C9 et conduit au péloruside A réduit.
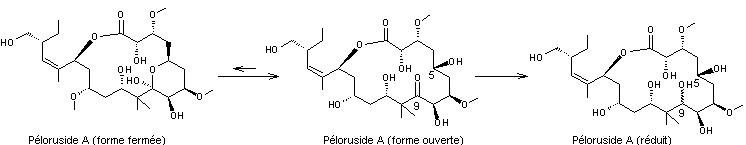
Comme
le Taxol®, le péloruside A provoque la polymérisation de la tubuline soluble en
microtubules. A partir d’une concentration de 100 nM et au bout de seulement
quelques minutes, aucune forme soluble de tubuline n’est détectable en présence
de ces deux composés. En revanche, quelle que soit sa concentration, le
péloruside A réduit n’a aucun effet sur la tubuline.
Voir Biosynthèse des protéines dans
l'abécédaire
Le Cis-platine
Un extrait d’article provenant du Journal of Chemical Education
sur la synthèse et l’étude de ce complexe est fourni ci-dessous :
The discovery and development of
Cisplatine 2 Journal of Chemical Education, vol 83, n°5, may 2006, pp. 728-734

La découverte du potentiel antitumoral de ce complexe est
totalement fortuite ; Barnett Rosenberg et coll. (Michigan State
University) étudiaient les effets possibles d'un champ électrique sur la
croissance d'Escherichia coli. Ils ont observé que les bactéries se
développaient sous forme de longs filaments, mais curieusement cessaient de se
diviser. Ce n'est qu'après un an de recherches sur les causes de cette
inhibition de la mitose, qu'ils ont montré que ce phénomène était provoqué par
un composé issu de l'électrode en platine ; il a fallu encore plusieurs années
pour que ces chercheurs démontrent que le cis-diamminedichloroplatine (II)
était extrêmement efficace contre certains cancers.
La synthèse de ce complexe, est effectuée au départ à partir de K2[PtI4]
réagissant sur l'ammoniac. On obtient d'abord le composé monosubstitué. La
seconde substitution conduit à une disubstitution en cis préférentiellement. On
convertit ensuite le composé iodé en composé chloré et on garde la
configuration cis. L'utilisation du composé iodé au départ est justifié par le
fait que l'on obtient ainsi le composé cis pratiquement pur.
Renseignements trouvés sur le site de la Société chimique de France
(societechimiquedefrance.fr)
Microtubule et tubuline
Les cellules eucaryotes ont un cytosquelette c'est-à-dire un
ensemble de polymères biologiques qui conditionnent ses propriétés
architecturales et mécaniques.
Ce cytosquelette est constitué de différentes protéines comme des
filaments d'actine ou les filaments intermédiaires par exemple mais aussi des
microtubules, petits tubes construits à partir de polymères de tubuline.
Les microtubules sont en continuelle modification, se
dépolymérisant et se polymérisant aux extrémités, à chaque instant.
Les microtubules sont notamment impliqués dans la mitose ; ils
jouent un rôle essentiel dans la séparation des chromosomes en formant une
structure très élaborée, le fuseau mitotique.