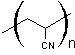
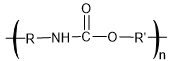
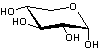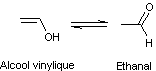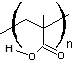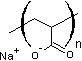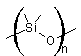MEMBRANES SELECTIVES ET APPLICATIONS
Gérard Gomez
Plan
de l’étude
1) Généralités
2) Membranes échangeuses d’ions
2-1) Introduction
2-2) Principe
de fonctionnement
2-3) Nature
chimique de ces membranes
2-4) Type de
membrane auxquelles conduisent ces différents polymères
2-5) Une application :
Pile à combustible
3) Autres membranes sélectives
3-1) Une autre application : la pervaporation
3-2)
Membranes sélectives utilisées pour la pervaporation
Annexe
1 Obtention d’une membrane PEMFC par Polymérisation
radicalaire vivante
Une membrane est une structure souple ou rigide, généralement fine, qui
sépare deux milieux et permet, limite ou empêche le passage de certaines
substances.
Elle agit comme une barrière qui laisse passer les particules , selon des critères physiques ou
physico-chimiques.
Les membranes sont utilisées dans des procédés de
séparation visant à isoler totalement ou partiellement certains constituants
d’un mélange.
Ces procédés sont regroupés sous le terme
de filtrations membranaires (voir l’article Filtrations).
On distingue principalement deux grandes catégories :
·
Filtrations
mécaniques : certaines membranes sont
conçues pour retenir globalement les particules supérieures à une certaine
taille, sans distinction de nature chimique. Elles agissent comme un tamis, et
c’est la dimension des pores de la membrane qui assure ce tri. C’est le cas de
la microfiltration et, dans une moindre
mesure, de l’ultrafiltration.
·
.Membranes sélectives :
lorsque d’autres critères que la taille jouent un rôle
dans la séparation — comme la charge électrique, la polarité, ou
l’affinité chimique — avec la membrane on parle alors de membrane
sélective. Ces membranes permettent une séparation plus fine, comme en nanofiltration, osmose inverse, dialyse, pervaporation ;
c’est aussi le cas avec les membranes échangeuse d’ions.
Remarque : Dans le cas de l’osmose
inverse on parle de membrane semi-perméable car elle ne laisse passer que le
solvant et retient tous les solutés. Le terme sélectif est plus général que le
terme semi-perméable.
Les membranes échangeuses d’ions et
celles utilisées dans la pervaporation vont faire l’objet de cette étude.
2) Membranes échangeuses d’ions
Les membranes échangeuses d'ions
permettent la séparation de certains ions présents dans une solution.
Elles jouent un rôle clé dans
les processus électrochimiques mis en jeu, par exemple dans les batteries, mais
aussi ceux mis en œuvre en biotechnologies et dans les procédés de traitement
de l’eau.
2-2) Principe de
fonctionnement
Les membranes échangeuses
d'ions se laissent traverser par certains ions présents dans une solution tout
en en retenant d'autres ; ce phénomène est désigné par le terme de « permsélectivité aux ions ».
Leur principe repose sur les
interactions électrostatiques entre les ions qui essaient de traverser ces
membranes et les ions fixes des groupements fonctionnels que porte le matériau
constituant la membrane.
Elles sont classées en deux
grandes catégories :
- membranes échangeuses de cations (MEC) :
Elles
possèdent des groupes fonctionnels fixes chargés négativement (par
exemple -SO3-) et elles se laissent traverser par des
cations (ions chargés positivement (Na+, Ca2+, H+).
Elles retiennent les ions
chargés négativement.
|
|
|
MEC Membrane
échangeuse de cations |
- membranes
échangeuses d'anions (MEA) :
Elles possèdent des groupes
fonctionnels fixes chargés positivement (par exemple des amines
quaternaires -NR3+). Elles se laissent traverser par des
anions (ions chargés négativement (Cl-, HO-, NO3-
…).
Elles retiennent les ions
chargés positivement.
|
|
|
MEA Membrane
échangeuse d’anions |
2-3) Nature chimique de
ces membranes
Ce sont des polymères obtenus
:
- soit à partir de polymères naturels, comme
par exemple :
·
La zéine, une prolamine hydrophobe,
majoritairement présente dans le maïs et constituée d'acides aminés hydrophobes
(leucine, proline, alanine) mais aussi d'acides aminés polaires comme la
glutamine (qui permet certaines interactions avec l'eau).
La zéine est insoluble dans
l'eau, mais soluble dans l'éthanol et d'autres solvants organiques.
·
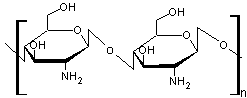
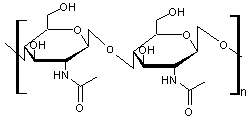
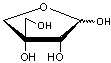
Le chitosane, un
polysaccharide dérivé de la chitine que l'on trouve par exemple dans les
carapaces de crustacés marins :
Le chitosane
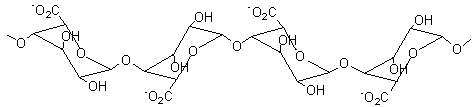
La chitine
Remarque : La
chitine est similaire à la cellulose, mais avec une
résistance accrue grâce aux liaisons hydrogène supplémentaires entre les
chaînes.
Le chitosane
qui dérive de la chitine par désacétylation du groupe acétamido
(un groupe amine -NH2 remplace le groupe -NH-CO-CH3)
trouve de nombreuses et importantes applications dans les domaines de
l'agriculture, la santé.... d'autant qu'il est
biodégradable grâce aux chitosanases et aux chitinases présents dans de nombreuses cellules.
·
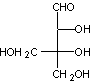
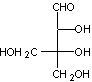
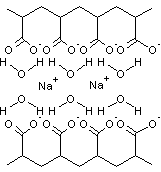
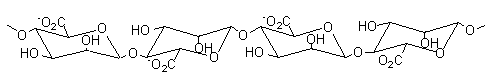
Les alginates sont
des polysaccharides extraits de la paroi cellulaire des algues brunes,
principalement Laminaria, Ascophyllum, Fucus (on peut aussi obtenir les
alginates par voie bactérienne).
Ce sont des copolymères
linéaires constitués de deux unités de base, l'acide α-L-guluronique, G, et l'acide β-D-mannuronique, M. Le rapport M/G dépend de l'algue de
départ et conditionne les propriétés physiques, chimiques et mécaniques du
polymère.
Ces unités de base sont groupées en blocs (blocs GG correspondant à des
molécules d'acide guluronique liés
en α-1->4, blocs MM correspondant à des molécules d'acide mannuronique liés en β-1->4, blocs MG
correspondants à des enchaînements irréguliers ou à des enchaînement alternés
d'acide guluronique et mannuronique),
chaque bloc ayant une longueur d'environ 15 à 20 unités (degré de polymérisation
de chaque bloc).
Les cations compensateurs sont généralement les ions sodium ou calcium.
Blocs GG
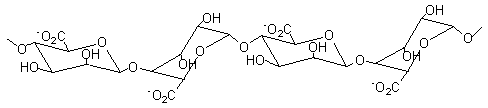
Blocs MM
Blocs MG

·
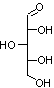
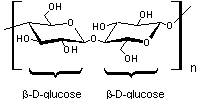
La cellulose
Résulte de la polycondensation de glucose (C6H12O6)
CH2OH-CHOH-CHOH-CHOH-CHOH-C(H)=O sous forme
de β-D-glucopyranose
On obtient des chaînes dîtes "linéaires".
Les différentes chaînes placées côte à côte sont liées
par de nombreuses liaisons hydrogène ce qui donne à ce matériau une très grande
rigidité et qui explique qu'elle est la substance de soutien (parois) des
cellules jeunes des végétaux.
La cellulose pratiquement pure est tirée du fruit du
cotonnier ; il contient des graines recouvertes d’un duvet formé de fibres de 2
à 7 cm de long; débarrassées des impuretés, ces fibres constituent le coton
hydrophile.
La cellulose s’obtient également à partir du bois;
le bois est essentiellement constitué de cellulose et de lignine; un traitement
à l’hydrogénosulfite de calcium détruit la lignine; il
reste la pâte de bois; on en fait le papier, le carton, ....
Elle n'est pas attaquable par les sucs digestifs de
l'homme. C'est une matière première de tout premier ordre dans l'industrie
chimique.
Elle est insoluble dans l'eau et la plupart des
solvants organiques et n'est solubilisée que par une solution ammoniacale
d'hydroxyde de cuivre (II) : la liqueur de Schweitzer. Son hydrolyse acide
conduit au glucose.
·
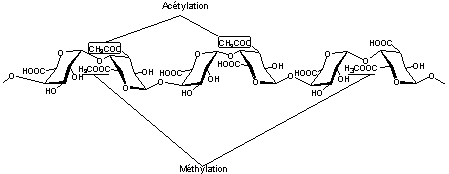
Les pectines
Il s'agit d'un ensemble
complexe formé d'une ossature majoritaire résultant d'un enchaînement d'acides
α-D-galacturonique liés en 1-4 (unités homogalacturonanes)
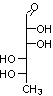
Certaines des unités homogalacturonanes
peuvent être méthylées et/ou acétylées :
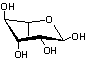
Certaines unités homogalacturonanes
peuvent être substituées par des oses :
-
Rhamnogalacturonanes
L'ose est alors le L (-)-rhamnose
:
|
|
|
-
Xylogalacturonanes
L'ose est alors le D(+)-xylose :
|
|
|
-
Apiogalacturonanes
L'ose est alors le D-apiose
|
|
|
On peut donner un aperçu général de la structure d'une
pectine par le schéma suivant :
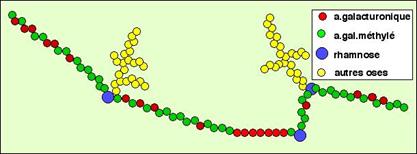
Roger PRAT, Michèle MOSINIAK, Jean-Claude ROLAND : La paroi
primaire de la cellule végétale ; les pectines.
Les pectines ont l'avantage
d'être biodégradables et renouvelables ; ce sont donc des polymères
intéressants pour des applications écologiques (traitement de l'eau).
- soit à partir de polymères synthétiques, en
particulier
·
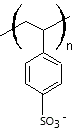
Des polymères sulfonés
comme le
polystyrène sulfoné (PSS) encore appelé poly(styrène
sulfonate de sodium).
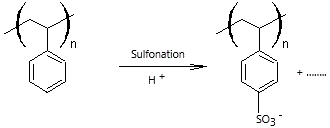
Remarque :
On peut obtenir le PSS :
* Soit par polymérisation du sulfonate de styrène
* Soit par sulfonation du polystyrène
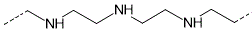
Cette méthode est bien moins
sélective que la précédente car le composé obtenu est un mélange de chaînes
diversement sulfonées (le nombre de groupements SO3-
n'est pas le même).
Ces PSS sont des résines
échangeuses de cations. On les utilise par exemple pour
fabriquer des membranes échangeuses de protons dans les piles à combustible.
Remarque :
L'éthylènedioxythiophène
peut s'allier au poly(styrène sulfonate) de sodium
pour donner le PEDOT:PSS

Ce PEDOT:PSS
améliore la conductivité et la stabilité des membranes échangeuses de protons.
·
De polymères aminés
comme le
polyéthylène imine ou le polyvinylamine, pour former
des résines échangeuses d'anions.
* Polyéthylène imine (ou PEI)
Plusieurs formes existent
-1- Forme linéaire
![]()
Cette molécule peut s'obtenir
part polymérisation par ouverture de cycle de l'azacyclopropane
:
![]()
-2- Forme ramifiée
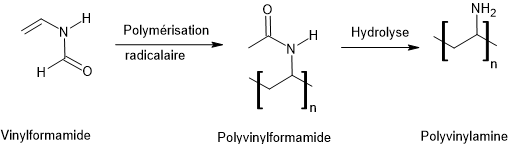
*Polyvinylamine(ou PVAm)
C'est un polymère
thermoplastique incolore et soluble dans l'eau.
Il est obtenu par hydrolyse du
polyvinylformamide, lui-même obtenu par
polymérisation radicalaire du vinylformamide :
Le polyvinylamine
(PVAm) possède des groupes amine (-NH₂) qui peuvent être
protonés en -NH₃⁺ en
milieu acide.
Ces groupes ammonium
positifs permettent d'attirer et d'échanger des anions (Cl⁻, SO₄²⁻, etc.), ce qui en fait une membrane échangeuse
d'anions.
·
De copolymères :
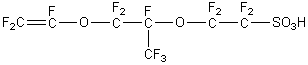
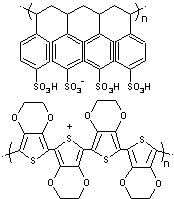
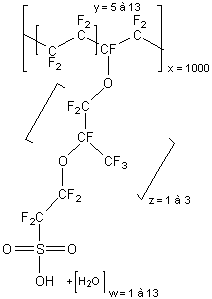
* Le PEFMC (Nafion
®)
|
|
Il s'agit
du copolymère du tétrafluoroéthylène : CF2
= CF2 (le monomère du PTFE (téflon) et de l'acide perfluoro-3,6-dioxa-4-méthyloct-7-ènesulfonique :
La chaîne principale est en
PTFE. Les groupes sulfonates hydrophiles facilitent la conduction des ions H+
dans un environnement humide. Cette membrane doit donc être maintenue
humide sous peine de baisse de conduction des ions H+ c’est-à-dire
une baisse de rendement de la pile. |
2-4) Type de membrane auxquelles
conduisent ces différents polymères :
|
Zéine |
MEC/Neutre |
|
Chitosane |
MEA |
|
Alginate |
MEC |
|
Cellulose |
Par modification chimique,
peut devenir MEC ou MEA |
|
Pectines |
MEC |
|
Rhamnogalacturonanes |
MEC |
|
Xylogalacturonanes |
MEC |
|
Apiogalacturonanes |
MEC |
|
PSS |
MEC |
|
PEI |
MEA |
|
Polyvinylamine |
MEA |
|
PEMFC (Nafion
®) |
MEC |
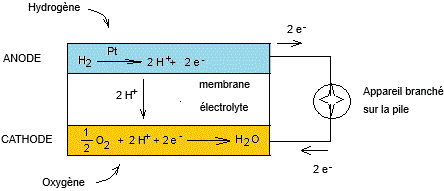
2-5) Une application : Pile à
combustible à membrane échangeuse de protons (PEMFC : Proton Exchange Membrane
Fuel Cell).
Une pile à combustible est un dispositif électrochimique
qui convertit directement l'énergie qu'est susceptible de fournir un
combustible (énergie chimique) en énergie électrique, avec production
éventuelle de chaleur, sans passer par une combustion.
Son fonctionnement fait intervenir une réaction
d'oxydoréduction entre un combustible et un oxydant.
Deux électrodes (anode et cathode) sont séparées par
une membrane électrolyte qui permet le transfert d'ions tout en bloquant les
électrons ; on force ces électrons à passer, lorsqu'on le souhaite, dans un
circuit externe (courant électrique).
Son fonctionnement est théoriquement illimité tant
qu'on l'alimente en combustible et en oxydant.
Les piles à combustible sont utilisées dans divers
domaines comme l'automobile, l'aérospatial ….
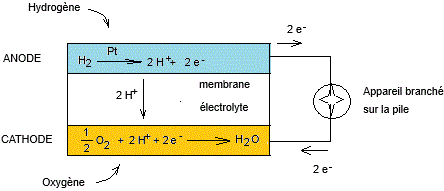
Un schéma qui résume le fonctionnement d'une pile à combustible dont le combustible est
l'hydrogène et l'oxydant est l'oxygène.
·
L'anode et la cathode sont constituées d'une fine couche de platine
(catalyseur) appliquée sur du carbone (fine couche poreuse) qui maximise
l'efficacité des réactions électrochimiques qui ont lieu.
·
La membrane
électrolyte peut être constituée d'un polymère
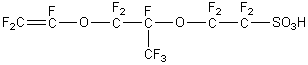
solide flexible et semi-transparent, le Nafion ®
|
Motif
du Nafion ® |
Il s'agit
du copolymère du tétrafluoroéthylène : CF2
= CF2 (le monomère du PTFE (téflon) et de l'acide perfluoro-3,6-dioxa-4-méthyloct-7-ènesulfonique :
La chaîne principale
est en PTFE (Voir annexe 1). Les groupes sulfonates
hydrophiles facilitent la conduction des ions H+ dans un
environnement humide. Cette membrane doit donc être maintenue humide sous
peine de baisse de conduction des ions H+ c’est-à-dire une baisse
de rendement de la pile. |
3) D’autres
membranes sélectives et une autre application :
3-1) Une
autre application : la pervaporation
La pervaporation ( perméation + évaporation
) est un procédé de séparation membranaire utilisé pour
séparer des mélanges liquides, par exemple des mélanges eau/éthanol, en
exploitant la différence de volatilité des composants.
Les
membranes utilisées n’ont pas de pores ; leur traversée se fait par le
phénomène de dissolution-diffusion.
La
dissolution-diffusion est le mécanisme fondamental qui gouverne le
transport de matière à travers les membranes polymères denses, comme celles
utilisées par exemple en osmose inverse.
On
distingue trois étapes :
·
Dissolution (ou
solubilisation)
Le ou les composants
du mélange liquide (souvent appelés pénétrants) doivent
d’abord se dissoudre dans la membrane.
Cette étape
dépend de :
- L’affinité
chimique entre le soluté et le matériau de la membrane
(hydrophile ou hydrophobe).
- La polarité,
la taille moléculaire, ou encore la capacité à former des liaisons faibles
(type Van der Waals, Hydrogène, etc.).
Seuls les
composants solubles dans la membrane peuvent potentiellement la traverser.
·
Diffusion à
travers la membrane
Une fois
dissous, les molécules diffusent à travers le matériau de la membrane,
selon un gradient de concentration ou de pression partielle.
Ce transport
suit généralement la loi de Fick (diffusion), et la vitesse dépend de
:
- La température
- La taille et la forme des
molécules
- La structure interne de
la membrane (mobilité de la chaîne polymère, densité de réticulation,
etc.)
·
La désorption (ou
évaporation).
En sortie de
membrane, les molécules traversées sont désorbées en phase vapeur, car
la face aval est placée sous vide ou balayée ce qui signifie qu’elle est
parcourue par un flux continu de gaz souvent inerte comme l’azote qui entraîne
les molécules évaporées qui viennent de traverser la membrane ; cela
facilite l’extraction des composés perméés.
La vapeur est
ensuite condensée pour être collectée.
On utilise le
phénomène de pervaporation :
Ø
Pour séparer les azéotropes qui
sont des mélanges impossibles à séparer par distillation comme le mélange
eau-éthanol à 95,6% en masse en éthanol à 1 atm. qui bout à 78,2°C.
Ø Pour le traitement de certains effluents industriels.
Ø
…..
On comprend que
cette séparation par pervaporation est basée sur la facilité avec laquelle les
différents composants du mélange franchiront les trois étapes.
Voici un
exemple de membrane et les conditions opératoires à respecter pour obtenir de
l’éthanol pratiquement pur à partir d’un mélange azéotropique
eau-éthanol :
o
Membrane dense, non poreuse.
o
Sélectivité hydrophile, pour
favoriser le transport de l’eau.
o
Matériaux courants : PVA
(Alcool polyvinylique, Nafion ® (polymère fluoré,
sulfoné), chitosane ou composites PVA-Silice pour
améliorer la stabilité.
o
Température d’alimentation :
60 à 80°C (augmente la perméation sans trop ramollir la membrane)
o
Vide côté perméat : <10mbar
(favorise l’évaporation de l’eau)
o
Epaisseur de la membrane : 10
à 100µm (compromis entre débit et sélectivité)
o
Pression d’alimentation :
atmosphérique
o
Balayage (optionnel) : gaz
inerte (azote) ou vide dynamique
3-2) Membranes
sélectives utilisées pour la pervaporation
Le choix de la
membrane dépend fortement de la nature du mélange, de la température et du
solvant majoritaire.
Ø
Séparation eau/ composé organique
(en fait il s’agit de retirer l’eau des solvants organiques (éthanol,
isopropanol, acétate d’éthyle notamment), c’est-à-dire que le composé organique
est majoritaire.
-
Membranes polymères hydrophiles-
PVA (alcool polyvinylique) - Nafion ® - Chitosane – Polyacrylates -
|
PVA (alcool polyvinylique) |
|
|
Polymère
courant, très souvent utilisé. On peut aussi utiliser des composites pVA/silice
(membranes hybrides). On les
représente par PVA-[SiO2]n.
Cela désigne un réseau de chaînes de PVA dans lequel sont dispersées des
nanoparticules de silice (SiO2), souvent sous forme de réseau
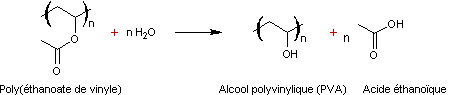
tridimensionnel ou agrégats. Remarque : Le PVA n'est pas obtenu par
polymérisation de l’alcool vinylique, mais par hydrolyse d'un autre polymère,
le poly (acétate de vinyle) :
Ceci tient au fait que
l'alcool vinylique n'est pas stable ; c'est sa forme tautomère l'éthanal qui
l'est :
|
|
|
Le chitosane permet de chélater les
métaux lourds, de floculer les matières organiques et minérales mais aussi
les microorganismes d'où son utilisation dans le traitement des eaux usées. Le chitosane est biodégradable ; il
dérive d’un composé naturel, la chitine
par désacétylation du groupe acétamido
(un groupe amine -NH2 remplace le groupe -NH-CO-CH3)
trouve de nombreuses et importantes applications dans les domaines de
l'agriculture, la santé.... d'autant qu'il est biodégradable grâce aux
chitosanases dans de nombreuses cellules. |
- Le poly(acide
acrylique) ou PAA
conviennent très bien ; ils sont très hydrophiles et
peuvent former des gels ; Le polyacrylate de sodium en particulier
enserre les molécules d'eau qui sont retenues par attraction électrostatique
comme indiqué ci-dessous
- Le
polyacrtylonitrile (PAN)
|
Ø
Séparation composé organique-eau,
c’est-à-dire que le composé organique hydrophobe est minoritaire :
concentration d’arômes dans l’industrie alimentaire, récupération de solvants
dans les procédés pharmaceutiques.
-Membranes polymères
hydrophobes (organophiles)-
Polydiméthylsiloxane (PDMS) – Polyuréthanes - Poly(éthylène-co-propylène) - Polyether-block-amide (PEBA) -
|
Ce matériau
très souple et hydrophobe. Il a une
très forte affinité pour les composés organiques. Il a une
perméabilité élevée. Il résiste à
des températures supérieures à 150°C. Il résiste à
de nombreux solvants. Il limite
l’adsorption de l’eau. On peut
l’utiliser pur, en film mince. Pour
améliorer la stabilité mécanique on peut le déposer sur un support poreux
(PAN, PES). On peut le
modifier (matériau composite) avec des charges (zéolithes) pour augmenter sa
sélectivité. |
Résultent de
l’action d’un di-isocyanate sur un diol. La nature de
R et R’ (groupes rigides ou souples) permet de moduler des propriétés des
polyuréthanes. On peut
ainsi ajuster l’hydrophilie ou l’hydrophobie du matériau. Il a une
bonne stabilité mécanique même en film mince. Il est
adapté à divers solvants organiques. Il est
compatible avec des charges organiques pour améliorer la sélectivité. Ils est compatibles avec d’autres polymères pour former des associations de
polymères (blends en anglais) pour optimiser ses
propriétés. |
|
Poly(éthylène-co-propylène) |
|
|
Le poly(éthylène-co-propylène), aussi appelé EP
(éthylène-propylène copolymère), est un élastomère non polaire composé
de monomères d’éthylène (–CH₂–CH₂–) et de propylène (–CH₂–CH(CH₃)–). Le ratio
entre éthylène et propylène est variable, ce qui influence les propriétés
mécaniques et la perméabilité. Hydrophobe, Bonne flexibilité, faible
absorption d’eau, Bonne stabilité thermique. |
C’est un un élastomère thermoplastique qui résulte de la
copolymérisation de blocs rigides de polyamide (PA6, PA11, PA12) et de blocs
souples de polyéther PE (PEG par exemple). Cette structure en blocs confère
au PEBA une combinaison unique de rigidité flexibilité et résilience. – Bonne
perméabilité aux composés organiques volatils. - Facilement transformable par injection, extrusion ou soufflage |
Obtention d’une membrane PEMFC par Polymérisation
radicalaire vivante :
L’obtention de la structure recherchée pour le
polymère n’est possible que si la polymérisation
est parfaitement contrôlée. Pour cela, une polymérisation
radicalaire vivante peut être obtenue
par addition dans le milieu de radicaux nitroxyle ; ceux-ci ont la particularité de terminer
réversiblement la croissance des centres actifs radicalaires P.
La définition donnée par l'IUPAC (Union
internationale de chimie pure et appliquée) de la polymérisation vivante est la
suivante :
"C'est une polymérisation en chaîne dont le
transfert et la terminaison de chaîne sont absents. Dans de nombreux cas la
vitesse d'initiation de la chaîne est rapide par rapport à la vitesse de
propagation de la chaîne, de sorte que le nombre de porteurs de chaînes
cinétiques est essentiellement constant tout au long de la
polymérisation."
La polymérisation se termine quand le monomère est
épuisé, mais l'extrémité de la chaîne demeure activée. On obtient des chaînes
de longueur sensiblement égales.
Rappelons que la longueur de chaîne, directement liée
au degré de polymérisation, influence diverses propriétés physiques du polymère
obtenu comme la viscosité, la température de transition vitreuse ou le module
d'élasticité.
On comprend alors que l'utilisation de polymérisations
vivantes permet d'obtenir des polymères à propriétés physiques définies.
On voit aussi que cette méthode se prête
particulièrement bien à l'obtention de copolymères en blocs de type
XXXXYYYYZZZZ ; en effet il suffit d'attendre que le monomère X soit épuisé pour
mettre le monomère Y puis Z.
Ces réactions sont très voisines des polymérisations
contrôlées ; dans celles-ci la terminaison est supprimée mais pas éliminée ce
qui veut dire qu'on peut placer le polymère dans un "état dormant" et
lui permettre de recommencer à s'allonger en modifiant par exemple la
température, ce qui réactive l'extrémité de la chaîne qu'un réactif P° était
venu provisoirement bloquer.
XXXX° + P° …….. XXXX-P En
chauffant légèrement XXXX-P ……… XXXX° + P°.
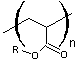
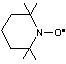
Un radical très utilisé pour bloquer provisoirement la
chaîne est le 2,2,6,6-tétraméthyl-1-pipéridinyloxy dont le nom est abrégé
en TEMPO :
Le blocage de la chaîne se fait par réaction des deux
radicaux :
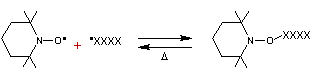
Un léger chauffage libère l'extrémité de la chaîne.