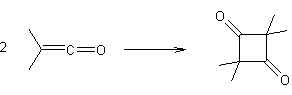LES SYNTHESES 6
Plan de l'étude : Plan
général des synthèses
|
Acide carbamique (dérivés) |
|
|
Diazonium
(sels de) |
|
|
1,2-Dicarbonylés
(composés) |
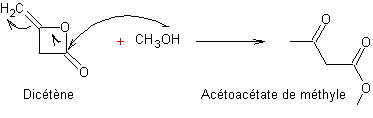
1,3-Dicarbonylés (composés) |
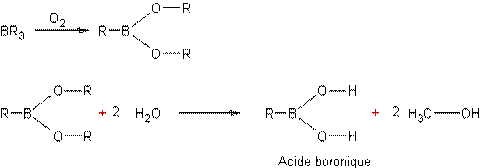
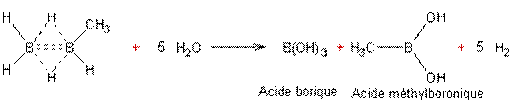
L'acide borique est le
trihydroxyborane, et l'acide méthylboronique est le dihydroxyméthylborane.
DERIVES DE L'ACIDE CARBAMIQUE
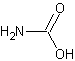
Rappelons la formule de l'acide carbamique :
- Addition des alcools aux isocyanates :
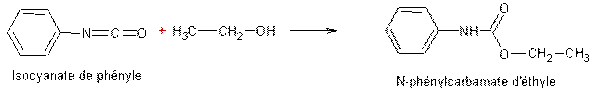
|
|
Le carbène est une entité de formule :CH2
électriquement neutre, dans laquelle l'atome de carbone n'a que deux liaisons
covalentes
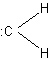
Cette molécule (carbène "ordinaire")
est la plus simple d'une série de composés : les carbènes
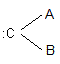
Exemple :
 ou :CCl2 dichlorocarbène
ou :CCl2 dichlorocarbène
On peut aussi avoir la forme
![]()
cyclopropylméthylidène
- A partir du chloroforme en milieu basique :
Exemple 1 :
En présence d'une base forte HO- le
chloroforme engendre l'entité CCl3- puis :CCl2
.
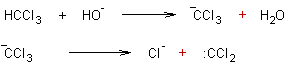
Le dichlorocarbène très réactif réagit ensuite
sur les molécules d'eau du milieu et deux réactions sont possibles :
![]()
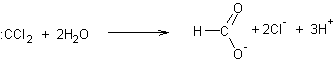
Exemple 2 :

- Irradiation du diazométhane
:
La photolyse du diazométhane H2CN2
provoque la formation du carbène et
d'azote N2.
![]()
Cette espèce, est très instable et n'existe que
comme intermédiaire réactionnel ; on a par exemple ensuite :
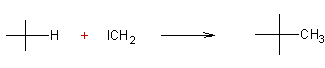
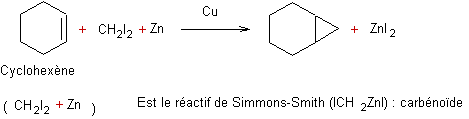
- Iodure de méthylène plus
zinc :
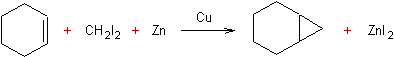
|
|
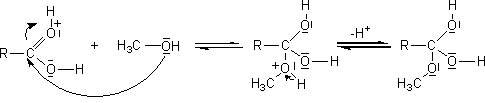
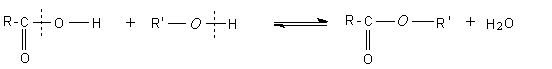
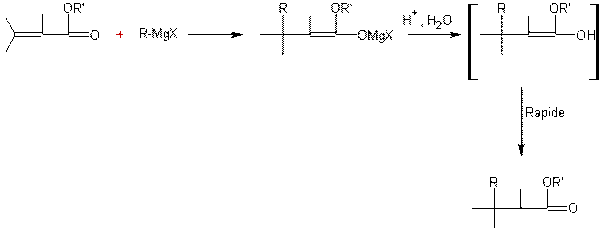
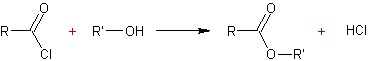
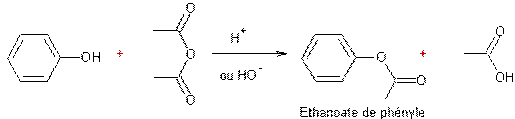
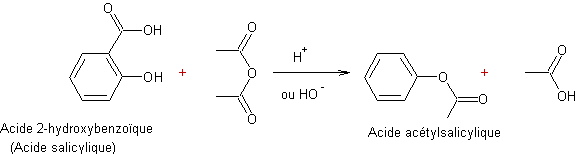
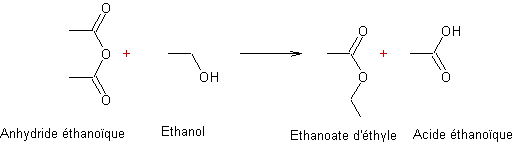
- Action des acides carboxyliques sur des alcools :
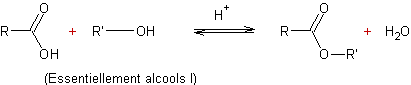
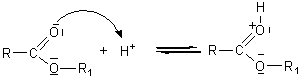
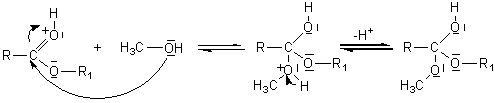
Mécanisme :
Il s'agit d'une addition nucléophile de l'alcool sur le carbone du groupement carboxyle de l'acide, après que l'oxygène doublement lié au carbone de ce groupement carboxyle ait été protoné.
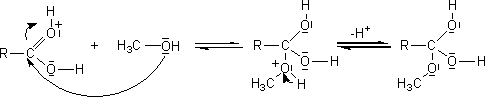
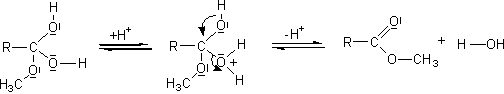
Le marquage isotopique
(utilisation de 18O au lieu
de 16O pour l'alcool) a
permis de montrer que l'oxygène de l'alcool se retrouvait (avec un alcool
primaire) dans l'ester et non dans l'eau d'ou les coupures des liaisons
suivantes:
Exemple 1 :
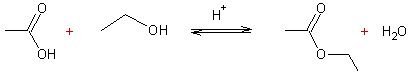
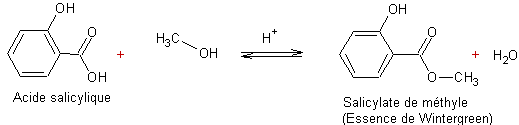
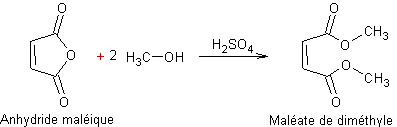
Exemple 2 :
- Addition d'anhydride éthanoïque sur des quinones :
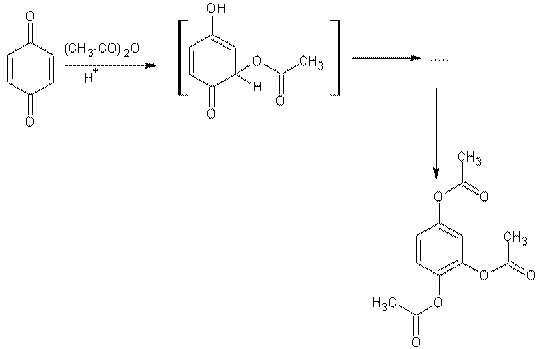
Exemple1 :
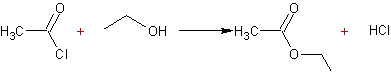
Exemple 2 :
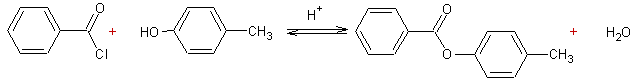
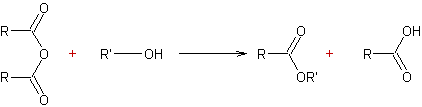
- Réaction des alcools avec les esters : Transestérification
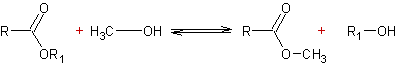
Mécanisme par catalyse acide :
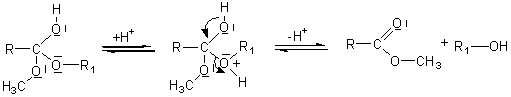
Exemple 1 :
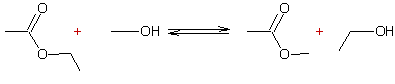
Exemple 2 : synthèse du poly(téréphtalate
d'éthylène glycol).
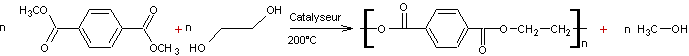
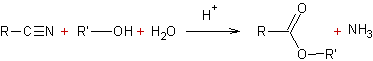
Exemple : Synthèse du diéthylmalonate à partir du
propanedinitrile :
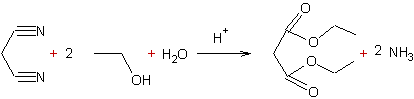
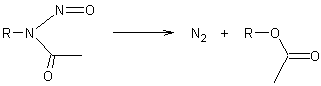
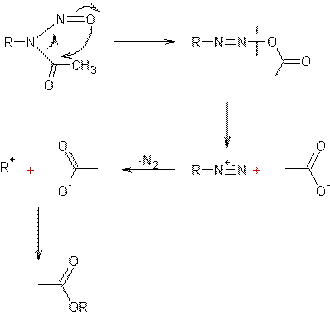
Mécanisme :
Exemple 1 :
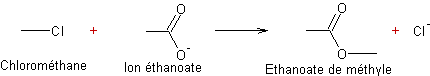
Exemple 2 :
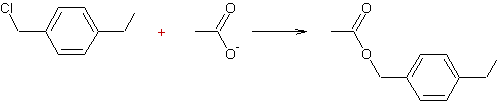
Chlorure de 4-éthylbenzyle Ethanoate de 4-éthylbenzyle
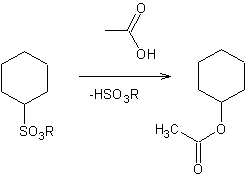
C'est une méthode utilisée dans certains cas particuliers : acides carboxyliques rares ou très peu stables.

Acide
1-cyclopropyléthanoïque 1-cyclopropyléthanoate
de méthyle
Exemple 1
Exemple 2
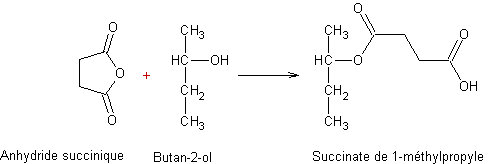
Exemple 1 :
Exemple 2 :
Exemple 3 :
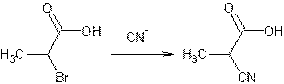
- Action des ions cyanures sur un acide α-halogéné :
- Addition du cyanure d'hydrogène sur un aldéhyde ou une cétone :
Ø Avec une cétone :
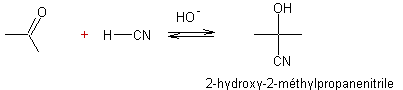
Mécanisme :

Remarque :
Avec
une cétone portant une double liaison conjuguée au C=O on obtient une
β-cyano-cétone
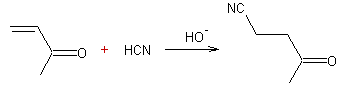
Ø Avec un aldéhyde :
Exemple 1
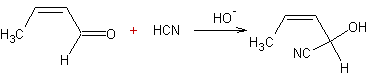
Exemple 2
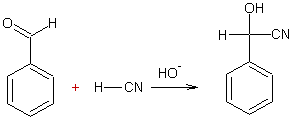
Exemple 1
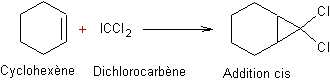
Exemple 2
Exemple 1
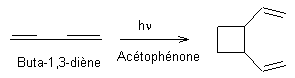
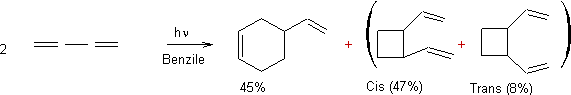
Remarque : en utilisant du
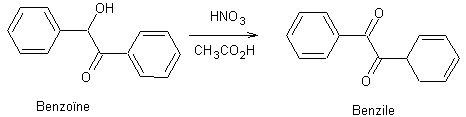
benzile au lieu d'acétophénone comme photosensibilisateur, on obtient :
50%
de
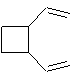
et
45% de
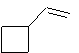
Exemple 2 :
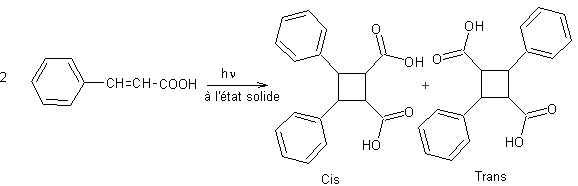
- Réduction des arènes par hydrogénation catalytique :
Exemple 1
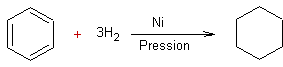
Exemple 2
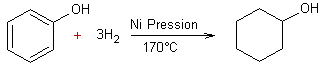
Exemple 3
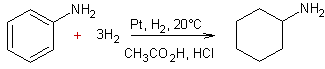
Exemple 4
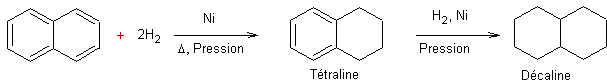
|
1,1-Cycloaddition des carbènes aux arènes |
|
Exemple 1
Exemple 2
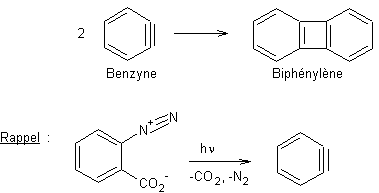
- 1,1-Cycloaddition des carbènes aux arènes :
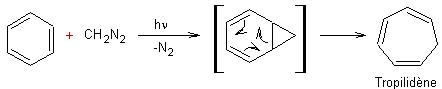
Remarque :
![]()
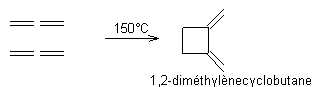
Une des réactions les plus utiles en synthèse
organique est l'addition 1-4 d'un alcène sur un diène conjugué; elle est
appelée réaction de Diels-Alder.
Exemple:
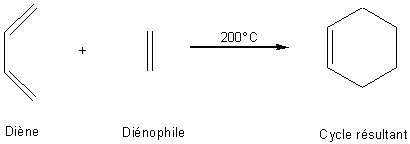
L'exemple ci-dessus est intéressant par sa
simplicité (il est pédagogique), mais le rendement de cette réaction est très
faible (environ 20%). Il faut dans une telle synthèse utiliser un diène riche
en électrons (par exemple substitué par des groupes électrodonneurs) et un
diénophile pauvre en électrons (par exemple un alcène substitué par des groupes
électroattracteurs: voir tableau ci-dessous).
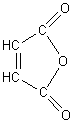
Des diènophiles très utilisés dans les réactions de
Diels-Alder
|
Tétracyanoéthylène |
|
Acrylonitrile |
|
|
Crotonaldéhyde |
|
Acroléine |
|
|
Acide
cinnamique |
|
Acrylate
d'éthyle |
|
|
|
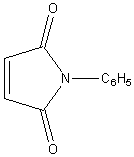
N-phénylmaléimide |
|
|
|
Maléate de
diméthyle |
|
Fumarate de
diméthyle |
|
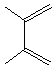
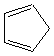
Des diènes souvent utilisés dans les réactions de
Diels-Alder
|
Buta-1,3-diène |
|
2,3-diméthylbuta-1,3-diène |
|
|
Cyclopenta-1,3-diène |
|
Cyclohexa-1,3-diène |
|
Exemple :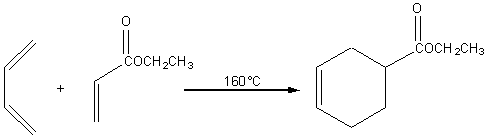
Le diénophile
utilisé dans cette réaction est l'acrylate d'éthyle. Le temps de réaction
nécessaire à un bon rendement (>90%) est élevé (> 12h).
En terme de
mécanisme, la réaction de Diels Alder s'effectue en une seule étape, c'est une
réaction concertée.
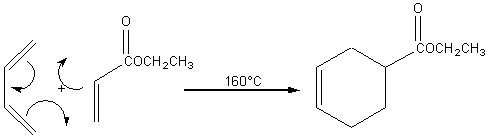
La réaction de Diels
Alder est stéréospécifique:
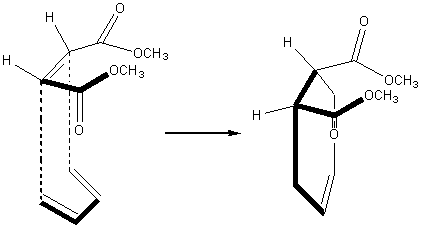
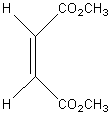
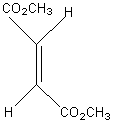
L' addition du
maléate de diméthyle qui a des groupes esters cis (ou Z), sur le 1,3-butadiène,
on obtient un cyclohexène cis (ou Z) substitué. Il y a rétention de la
configuration du diénophile. La stéréochimie du diènophile est conservée et
avec un autre diène on montrerait que celle du diène l'est aussi.
Une cycloaddition
(réaction de Diels-Alder avec un diène cyclique par exemple) conduit au dérivé
endo seulement.
·
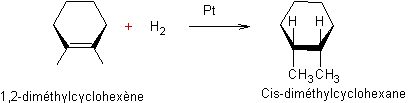
Addition d'halogénocarbènes aux cycloalcènes :
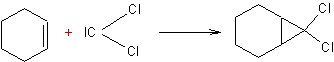
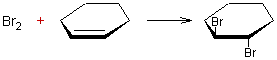
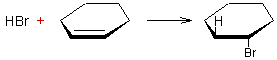
Exemple 1 :
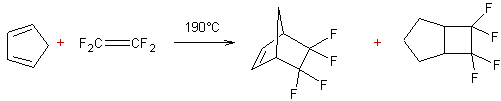
Exemple 2 :
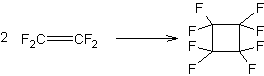
- A partir des N- nitrosoalkylamides en milieu alcalin :
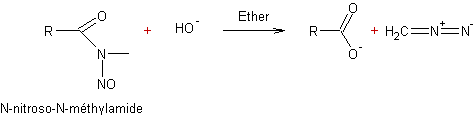
- Couplage des sels d'aryldiazonium avec des amines (I)ou (II)
![]()
Exemple :
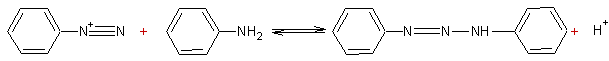
- Action des ions cyanures sur les sels d'aryldiazonium :
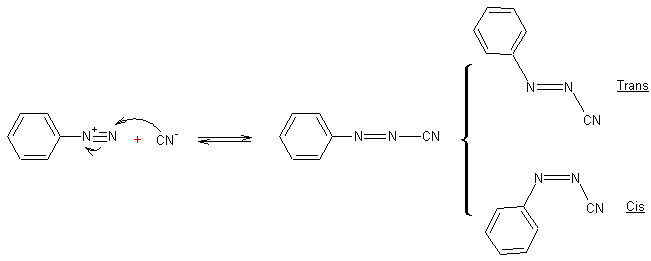
Cyanure
de benzène diazonium
- Amines (I) et acide nitreux :
Exemple 1 :
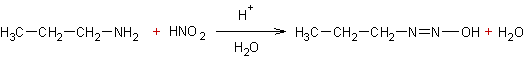
![]()
Exemple 2 :
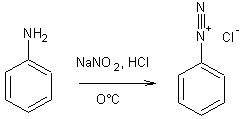
- Sels d'aryldiazonium et ion hydroxyde :

Remarque :
Les sels de ces acides
sont stables en milieu basique. Les sels de l'acide
trans-p-nitrobenzènediazotique sont vendus dans le commerce et conduisent aux
sels de p-nitrobenzènediazonium en milieu acide.
- Sels d'aryldiazonium et ions carboxylates :

-
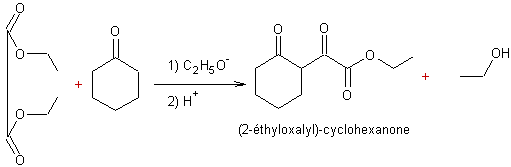
Condensation de l'oxalate d'éthyle avec des cétones :
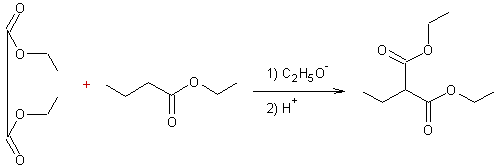
- Condensation de l'oxalate d'éthyle avec les esters :
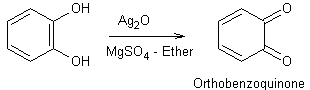
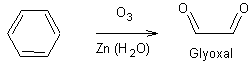
|
|
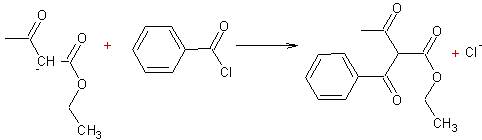
v Les esters dont l'atome de carbone
en a du groupement fonctionnel porte un ou des atomes
d'hydrogène, peuvent subir une réaction d'autocondensation qui conduit à un b céto-ester :
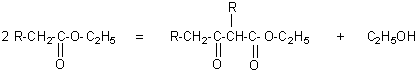
Exemple:
v
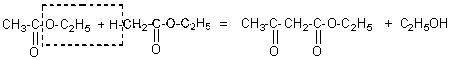
La réaction a lieu en milieu basique fort:
éthanolate de sodium
v Mécanisme:
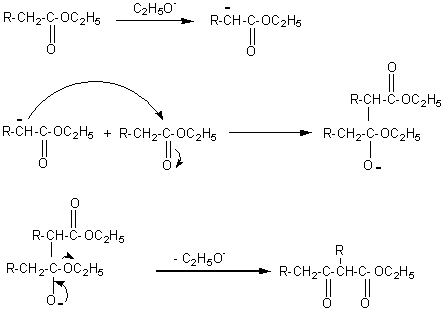
On peut aussi faire
réagir une cétone et un ester en milieu fortement basique (C2H5O-)
et on aboutit par le même mécanisme à une b-dicétone.
C'est une
condensation comparable à celle de Claisen qui intervient avec les diesters,
condensation intramoléculaire qui a lieu si le cycle formé est sans
"contrainte" c'est-à-dire si c'est un cycle à 5 ou 6 sommets (de type
cyclopentane ou cyclohexane). Avec l'heptanedioate de diéthyle par exemple on
obtient le 2-oxocyclohexanecarboxylate d'éthyle.
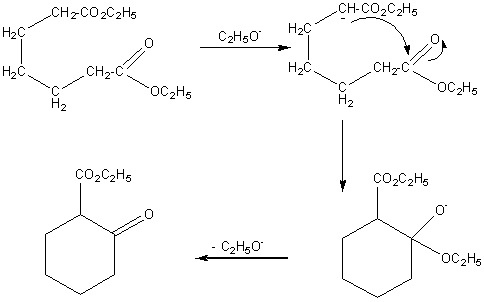
Exemple 1 :
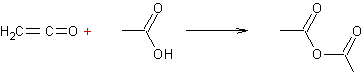
Exemple 2 :