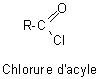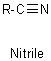LES ACIDES
CARBOXYLIQUES
et leurs dérivés.
1) Généralités
2) Nomenclature
3) Propriétés
physiques
4) Réactivité et propriétés chimiques
5) Les diacides
6) Dérivés
des acides carboxyliques
1) Généralités
Groupement caractéristique,
carboxyle :-COOH
![]()
![]()
2) Nomenclature
Les acides carboxyliques sont nommés
d'après la nomenclature de substitution.
On remplace le "E"
terminal de l'hydrocarbure parental par le suffixe "OÏQUE" et on fait
précéder le nom par le mot "acide".
Étant donné qu'un acide carboxylique
est toujours en bout de chaîne, il ne nécessite pas d'indice de position. Le
carbone du groupement COOH est le n° 1, ce qui fixe la numérotation de la
chaîne.
3) Propriétés
physiques
Les acides acycliques linéaires sont
des liquides ou des solides dont le point de fusion ne dépasse pas 100°C. Par
contre, ils possèdent les points d'ébullition les plus élevés parmi les
composés possédant une fonction simple sur une chaîne donnée. La solubilité
dans l'eau des acides carboxyliques est totale jusqu'en C4, diminue et devient nulle à partir de C9, les sels de
sodium des acides de C12 à C18 forment ce que l'on appelle les savons.
4) Réactivité
et propriétés chimiques
Un acide carboxylique réunit deux
groupements qui ne sont pas indépendants l' un de l'
autre.
Groupe -OH: l'
hydrogène est plus labile que celui des alcools. Les acides
carboxyliques sont dissociés en solution aqueuse.
R-COOH + H2O = R-COO-
+ H3O+
Groupe C=O: le carbone fonctionnel
des acides est nettement moins électrophile que celui des aldéhydes et des
cétones. En conséquence , les réactions d'addition
nucléophiles sont peu nombreuses.
4-1) Propriétés Acido-Basiques :
Le caractère dominant
des acides carboxyliques est leur acidité. Ce sont des acides faibles:
R-COOH/R-COO- . L anion carboxylate est représenté par:
![]()
Selon la nature
des groupements R (électroattracteur) les acides
carboxyliques seront plus ou moins forts.
4-2) L'état naturel
De nombreux
acides carboxyliques sont présents dans la nature mais le plus souvent sous
forme d'esters. Plus particulièrement les corps gras végétaux et animaux sont
des esters du glycérol de divers acides gras acycliques à chaîne linéaire plus
ou moins longue.
On rencontre
aussi:
l'acide
lactique dans le lait et dans les muscles :
![]()
l'acide citrique présent dans les
agrumes
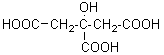
4-3) Termes importants et utilisation:
L'acide
acétique utilisé pour la préparation de tout ce qu'on appelle acétate ( vinyle, éthyle, cellulose...)
CH3COOH
L'acide
acrylique:
![]()
L'acide stéarique:

5) Les diacides
L'acide
oxalique
ou éthanedioïque est un puissant
réducteur:
COOH-COOH
L'acide orthophtalique ou acide benzènedicarboxylique:
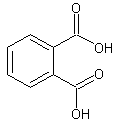
6) Dérivés des acides carboxyliques
|
|
|
|
Amide I |
|
6-1) Halogénures
d'acyle (ou halogénures d'acide) :
Ce sont
d'importants intermédiaires de synthèse. Ils proviennent du remplacement de OH par un halogène, le plus souvent par le chlore.
Les chlorures d'acyle
sont solubles dans l'eau mais rapidement hydrolysés en acides carboxyliques:
![]()
On peut les
obtenir en traitant l'acide correspondant par le pentachlorure
de phosphore PCl5.
Du fait des
interactions électrostatiques intermoléculaires, ils présentent un point d' ébullition élevé.
Ils possèdent
une odeur irritante et sont souvent utilisés comme gaz lacrymogènes.
Parmi les gaz
de combat, le dichlorure de l'
acide carbonique est un gaz mortel (Phosgène: COCl2) car il s' hydrolyse
dans les poumons.
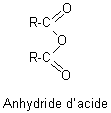
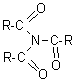
6-2) Anhydrides d' acide:
Ils proviennent
de la déshydratation intermoléculaire de deux molécules d' acide.
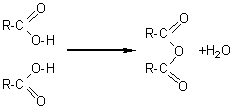
On les nomme en remplacant le mot acide par anhydride. On connait des anhydrides symétriques (les deux molécules d'acides déshydratés sont les mêmes) et des anhydrides mixtes (les deux molécules d'acides déshydratés sont différentes).
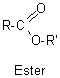
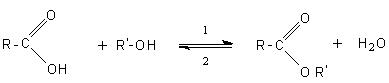
6-3) Les esters:
Les alcools
réagissent avec les acides carboxyliques pour former des esters. Cette réaction
est catalysée par les acides forts comme H2SO4 et elle est renversable.
On aboutit
toujours a un état final où les quatre produits
coexistent. Avec un alcool primaire, c' est le
groupement OH de l'acide qui part avec le H de l' alcool.
Pour les nommer, on enlève le mot acide et on
change la terminaison OIQUE par OATE dans le nom de l'acide puis on fait suivre
du nom du groupe alkyle de l'alcool .
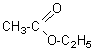
Ethanoate
d' ethyle:
On retrouve les
esters en parfumerie et dans les industries alimentaires car ils possèdent
généralement une odeur fruitée et florale. En alimentation, les esters sont souvents utilisés pour remplacer les saveurs naturelles.
Les esters sont
aussi utilisés pour la préparation des laques et des vernis.
Les esters à
point d'ébullition élevé sont employés comme agents plastifiants pour les résines dont
certaines sont elles-mêmes des polyesters.
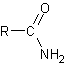
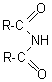
6-4) Les amides
Les préparations les plus fréquentes sont:
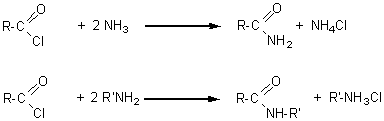
Il existe trois types d'amides selon le degrés de substitution de l'azote.
|
|
|
|
Il existe aussi des amides N substitués par
des groupements alkyles (R-CONHR' et R-CONR'R")
Les amides sont
solides excepté le formamide
(HCONH2).
Les amides I et
II sont fortement associés par des liaisons hydrogènes intermoléculaires.
On se sert
principalement des amides primaires pour effectuer des synthèses.