CETONES
1) Formule générale
2) Formule brute
3) Nomenclature
4) Propriétés Physiques
5) Propriétés chimiques
6) Les dicétones
7) Résumé
1)Formule générale :
![]() ou
ou ![]()
groupement
fonctionnel : C=O (carbone trigonal plan)
Remarque: le groupement C=O que l'on trouve aussi
dans les aldéhydes, fait que l'on englobe ces 2 familles dans un ensemble
appelé composés carbonylés.
2)Formule brute :
pour
une cétone saturée : CnH2nO avec
n>2
3)Nomenclature :
Le
nom se déduit de celui de l'hydrocarbure correspondant en ajoutant la
terminaison one (le groupement fonctionnel est toujours à l'intèrieur de la
chaîne), précédé du numéro du carbone fonctionnel (le plus petit possible).
Quelques
cétones saturées: CH3-CO-CH3 Propanone ou acétone
CH3-CH2-CO-CH3 Butanone
CH3-CH2-CO-CH2-CH2-CH(CH3)- CH3 6-méthylheptan-3-one
CH3-CO-CH2-COOH Acide 3-oxobutanoïque
(dans
des fonctions mixtes si le groupe cétone n'est pas
prioritaire, il
est
désigné par le préfixe oxo).
CH3-CH=CH-CH2-CO-CH2-CH3 Hex-5-ène-3-one (le groupe cétone est prioritaire par rapport à la double liaison).
4) Propriétés physiques
:
Elles
sont liquides ou solides.
teb:
CH3-CO-CH3 56°C
CH3-CH2-CO-CH3 80°C
CH3-CO-CH2-CH2-CH3 102°C
CH3-CH2-CO-CH2-CH3 102°C
Propriétés
voisines de celles des aldéhydes; ce sont de bons solvants.
La liaison C=O est polarisée (O plus électronégatif que C) avec + pour C et - pour O. Il y aura donc possibilité d'additions avec attaque du Carbone par des réactifs nucléophiles:
-Hydrogénation par LiAlH4,
suivie d'une hydrolyse ;
c'est
une réaction spécifique et les liaisons éthyléniques ne sont pas hydrogénées.
Tout
se passe comme s'il s'agissait d'une addition du nucléophile H-
![]()
- Additions
d'organo-magnésiens :
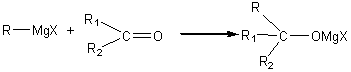
puis
par hydrolyse
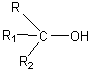
(alcool
III)
Tout
se passe comme s'il s'agissait d'une addition du nucléophile R-
- Additions
d'alcools: (acétalisation)
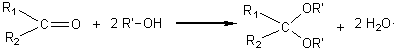
blocage
de la fonction carbonylée par formation d'un acétal; on peut ensuite régénérer
le groupement C=O par action de l'eau.
- Addition
de l'ammoniac et des amines primaires :
L'ammoniac
et les amines primaires R-NH2 donnent
avec les cétones (mais aussi les aldéhydes) des imines par addition conduisant
d'abord à un aminoalcool, qui se déshydrate.
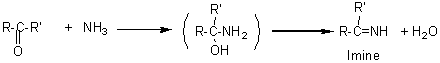
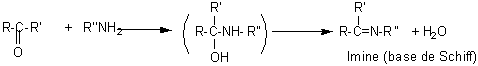
- Addition de cyanure
d'hydrogène :
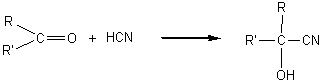
(Nitrile
alcool tertiaire)
L'hydrolyse
conduit à un alpha acide alcool.
- 5-2) Hydrogénations catalytiques : (Ni catalyseur;température + pression)
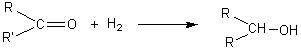
- 5-3) Mobilité des H voisins du groupement carbonyle :
- Enols:
Dans
l'eau, existence de 2 formes en équilibre R'-CH2-CO-R
(forme carbonylée) et 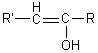 (forme énolique) Ces 2
formes sont tautomères.
(forme énolique) Ces 2
formes sont tautomères.
- Cétolisation
:
En
milieu basique (OH-) une molécule de cétone peut s'additionner à une
molécule d'aldéhyde pour donner un cétol:
CH3-CO-CH3+ CH3CHO ![]() CH3-CO-CH2-CHOH-CH3 (4-hydroxypentan-2-one).
CH3-CO-CH2-CHOH-CH3 (4-hydroxypentan-2-one).
Le
cétol formé, peut être déshydraté, pour donner une crotone: CH3-CH=CH-CO-CH3 La
déshydratation est une crotonisation.
Remarque:
L'addition cétone+cétone en milieu basique peut également avoir lieu , mais
avec un rendement plus faible.
-Réaction haloforme : (cas des méthylcétones)
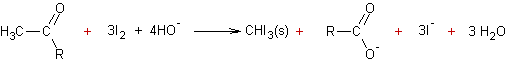
Il
se forme un précipité jaune de triiodométhane (iodoforme) lors de cette
réaction.
Elle
constitue un test qui permet de reconnaître les méthylcétones.
Remarque: ce test
se révèle positif pour les cétones méthylées, mais ausi pour l'éthanal,
l'éthanol, le propan-2-ol. Il faut donc être sûr que le composé testé est une
cétone avant de conclure qu'il s'agit d'une cétone méthylée, quand le résultat
du test est positif.
- 5-4) Caractérisation des cétones (composé carbonylé):
- Additions
de l'hydrogénosulfite de sodium : (cétones méthylées)
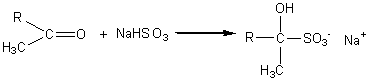
Le
dérivé bisulfitique cristallisé,blanc permet de caractériser la cétone (point
de fusion).
- Condensation avec la
2-4-DNPH:
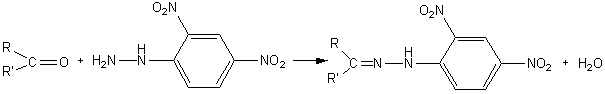
Le
composé formé est la 2-4-dinitrophénylhydrazone de la cétone.
- Condensation avec
l'hydroxylamine :
![]()
On
obtient une oxime, composé cristallisé, blanc,qui permet de caractériser la
cétone (point de fusion).
Remarque: Ces trois
réactions, ne permettent pas de distinguer aldéhydes et cétones.
Pour
les distinguer on utilise les propriétés réductrices des aldéhydes.
6) Les dicétones :
6-1) Les b-dicétones :
R-CO-CH2-CO-R',
les plus importantes des dicétones.
6-1-1) Préparation :
Par
condensation de Claisen entre une
cétone et un ester.
Exemple :
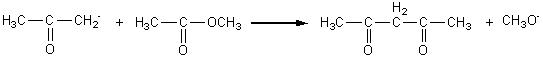
Le
nom de la cétone formée est la pentane-2,4-dione.
6-1-2)
Propriétés chimiques :
Les
hydrogènes du carbone placé entre les deux groupes CO sont extrêmement labiles
; en milieu basique, on peut facilement former un carbanion, ce qui conduit par
réaction avec un halogéno alcane R-X par substitution nucléophile à fixer R-
sur ce carbone intermédiaire :
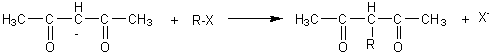
Et
la réaction peut se poursuivre, identique, avec l'hydrogène restant.
En
milieu basique les dicétones peuvent aussi subir une coupure :
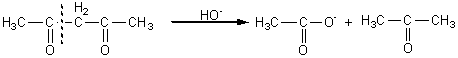
6-2) Les a-dicétones :
6-2-1) Préparation :
Par
oxydation avec le dioxyde de sélénium, on peut transformer la butanone en
butanedione, c'est la réaction de
Riley :
Par oxydation nitrique de la benzoïne on obtient le
benzile :
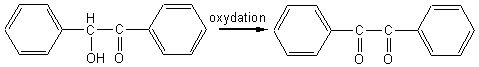
6-2-2) Propriétés chimiques
:
Se
comportent à beaucoup d'égards comme une cétone simple.
Par
chauffage en milieu basique cependant se produit un réarrangement dit
"benzylique" :
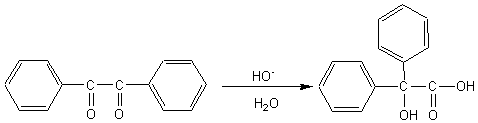
Résumé des principales propriétés chimiques :