L'ANILINE
Plan de l'étude
1) L'aniline
1-1) Historique
1-2) Préparation
1-3)
Propriétés physiques
1-4)
Propriétés chimiques
1) L'aniline
1-1) Historique
Trois scientifiques
allemands sont à l'origine de la découverte de l'aniline :
![]()
- Otto Unverdorben un pharmacien qui en 1826 isole une
nouvelle espèce chimique, à laquelle il donne le nom de "Krystalline",
à partir d'une distillation sèche de l'indigo
- Friedlieb Ferdinand Runge, ingénieur chimiste à
Oranienbourg (près de Berlin) qui en 1834 obtient la même espèce à partir des
goudrons de houille ; une espèce basique qu'il appelle cyanol à cause de
sa légère coloration bleue en présence de composés chlorés.
- Carl Julius von Fritzsche, un chimiste, qui en 1840
prépare à nouveau cette molécule en faisant réagir de l’indigo avec de la
potasse ; l’indigo étant extrait de la plante Indigofera anil, il
donne le nom d’aniline à ce nouveau composé organique.
Il
faut, pour compléter ce tour d'horizon des savants qui ont approché l'aniline
au moment de sa découverte, signaler :
v
Nicolaï Zinin Professeur à Kazan et à
St Pétersbourg qui montre en 1842 que l'aniline peut être préparée par
réduction du nitrobenzène.
v
August Wilhelm von Hofmann qui prépare
en 1856 un beau colorant, le rouge d'aniline en faisant agir du tétrachlorure
de carbone sur de l'aniline brute (contenant aussi de la toluidine).
v
William Henry Perkin senior, un élève
de Hofmann, qui devient le fondateur réel de l'industrie des colorants à
l'aniline grâce à sa "mauvéine" un colorant mauve qu'il obtient en
1856 par oxydation de l'aniline brute (Il s'agit en fait d'un composé se
formant à partir des trois molécules aniline, ortho-toluidine et para-toluidine
oxydées en milieu sulfurique par le dichromate de potassium. Il se forme
d'ailleurs deux composés, la mauvéine A et une autre molécule ayant un
groupement méthyle en plus, la mauvéine B).
|
|
|
|
Mauvéine
A |
Mauvéine
B |
"Le
6 avril 1865, l'ancien joaillier et fabricant de gaz d'éclairage Friedrich
Engelhorn fonda à Mannheim la Badische Anilin & Sodafabrik (BASF) ;
en raison de difficultés survenues dans l'acquisition du terrain nécessaire à
la construction de l'usine, celle-ci fut finalement bâtie la même année sur la
rive opposée, la rive gauche du Rhin à Ludwigshafen (en territoire bavarois) ;
elle devint l'une des plus grandes entreprises industrielles."
(Extrait
de "Histoire de la chimie" par G. Lockemann – Dunod – 1962)
L’aniline
est alors largement utilisée à l’échelle industrielle pour la production de
colorants, comme la fuchsine.
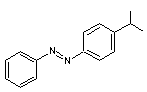
Ces
colorants seront rapidement supplantés par un nouveau type de molécules, les
colorants azoïques, obtenus à partir d’aniline par des réactions de
diazotation, comme par exemple le jaune de méthyle
1-2) Préparation
Aujourd’hui,
l’aniline reste un composé organique de première importance. Elle est préparée
par réduction du nitrobenzène (réduction de Béchamp).
![]()
![]()
ou
(mais plus rarement) par action d’ammoniac sur le chlorobenzène.
![]()
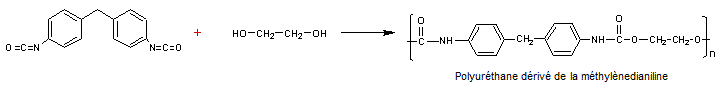
La plus
grosse partie du tonnage d'aniline produit est utilisée dans la chimie des
polymères, en particulier pour la préparation de méthylènedianiline, un
précurseur des polyuréthanes
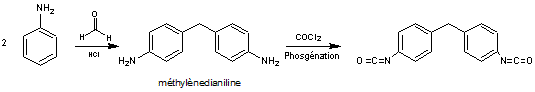
Les
colorants noirs à base d’aniline comme le noir d'aniline dont la composition
est complexe et dont on peut donner l'un des motifs
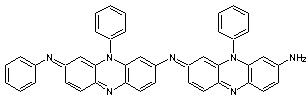
sont
encore employés pour la teinture des cuirs, dans les encres d’imprimerie ou
pour le marquage du linge.
L’aniline
reste utilisée dans le procédé de vulcanisation des caoutchoucs où elle joue le
rôle d'accélérateur de vulcanisation en réduisant la durée de chauffage
nécessaire et en améliorant la qualité du produit.
Dans le
domaine pharmaceutique on l'utilise pour la conception d’agents bactéricides
tels que les dérivés du sulfanilamide
![]()
1-3) Propriétés
physiques
C'est
un liquide huileux, incolore quand il vient d'être distillé, mais qui brunit à l'air
et à la lumière. Il possède une odeur caractéristique d'amine.
|
Masse
molaire |
T de
fusion |
T
d'ébullition |
Densité |
Indice de
réfraction |
|
93,13
g.mol-1 |
-6,2°C |
184,32°C |
1,0216 |
1,5863 |
|
Solubilité
|
Azéotrope
eau-aniline |
Risques |
pKa |
|
|
Eau:
34g.L-1 à 20°C éthanol,éther,benzène |
Composition:
19,2% d'aniline (en masse). |
Toxique (R: 20/21/22-40-48/23/24/25 S: 28-36/37/44) |
4,6 à
25°C |
Risques
lors de son utilisation
- Il est combustible et explosif lorsqu'il
est mis en contact avec l'acide perchlorique ou le méthanal
|
|
|
|
Acide
perchlorique |
Méthanal |
- Il s'enflamme aussi spontanément
lorsqu'il est mis en contact avec l'acide nitrique (HNO3) fumant ou
les peroxydes de sodium ou de potassium.
|
|
|
|
Peroxyde
de sodium |
Peroxyde
de potassium |
- Il s'oxyde de façon violente avec
le peroxyde d'hydrogène (H2O2), le chlorate de sodium
(NaClO3), l'acide chromique (H2CrO4) ou
l'acide hypochloreux (HClO).
- L'exposition à l'aniline engendre
la méthémoglobine (voir annexe1).
1-4) Propriétés
chimiques
On peut
résumer quelques propriétés chimiques de l'aniline
On
va maintenant les détailler
1- Caractère basique
de l'aniline
L'aniline
a un caractère basique, qui est dû au doublet d'électrons présent sur l'azote
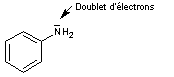
La
délocalisation du doublet vers le noyau aromatique diminue ce caractère
basique.
En
milieu acide :
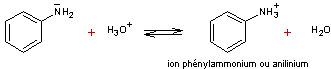
L'ion
anilinium rend l'aniline soluble dans l'eau ; la plupart des synthèses faites à
partir de l'aniline commencent par sa solubilisation dans l'acide
chlorhydrique.
2- Réaction de
Sabatier
La
présence du doublet libre de l'azote explique le caractère nucléophile de
l'aniline qui donne lieu à la réaction de Sabatier (action sur le carbone d'un
alcool) et la réaction d'Hofmann (action sur le carbone d'un dérivé halogéné) ;
dans ces deux cas le carbone fonctionnel est un site pauvre en électrons.
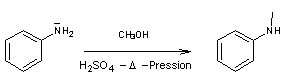
L'action
d'un alcool, ici le méthanol, en milieu acide conduit à une N-alkyle aniline,
ici la N-méthylaniline
Mécanisme
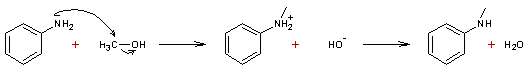
3- Réaction
d'Hofmann
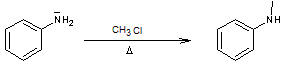
Mécanisme
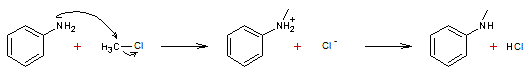
4- Diazotation
C'est
la réaction la plus importante de l'aniline et des amines aromatiques
primaires; il s'agit de l'action de l'acide nitreux HNO2.
![]()
Le composé obtenu est un sel de diazonium ; il peut être conservé plusieurs
heures à 0°C.
Le
mécanisme est le suivant :
Il
s'agit d'une attaque électrophile de NO+ sur le doublet de l'azote
de l'aniline.
En
partant du nitrite de sodium
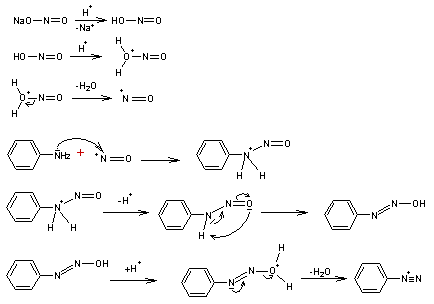
5- Réaction
de Sandmeyer (I)
Cette
réaction permet d'obtenir les chloro ou bromo benzène en traitant le sel de
diazonium par l'acide chlorhydrique ou bromhydrique, en présence d'un
catalyseur qui est le chlorure de cuivre(I) ou le bromure de cuivre(I).
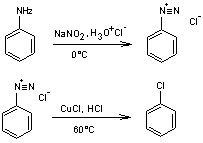
Mécanisme :
Le mécanisme
de cette réaction est complexe et fait intervenir des radicaux, c'est une
substitution aromatique, radicalaire-nucléophile.
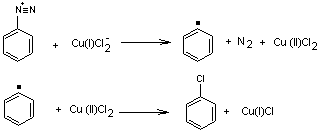
6- Réaction
de Sandmeyer (II)
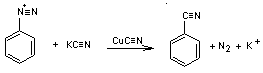
7- Couplage
de l'ion diazonium
L'ion
diazonium peut réagir comme électrophile asez faible soit avec une amine
aromatique soit avec un phénol, on obtient un composé coloré : un azoïque amine
ou un azoïque phénol.
![]()
Dans l'exemple choisi le composé obtenu est le jaune de méthyle ou jaune de beurre (car il était
autrefois utilisé comme colorant des matières grasses).
Le
mécanisme est le suivant :
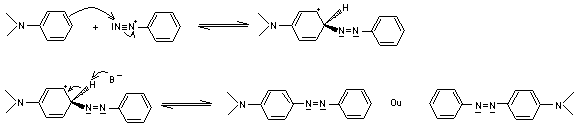
La plupart des composés ainsi obtenus sont colorés car les nombreuses
conjugaisons entre doubles liaisons qui existent dans la molécule, déplacent le
spectre d'absorption vers le visible.
Les molécules obtenues sont des colorants
azoïques à la condition d'être salifiables.
La réaction de couplage encore appelée copulation est une substitution électrophile.
Les
azoïques phénols sont solubles dans les bases alcalines, les azoïques amines
sont solubles en milieu acide.
La copulation avec un phénol a lieu en milieu basique; c'est l'ion phénoxy qui
réagit sur l'ion diazonium:
![]()
8- Acylation
du groupe amine (Action d'un chlorure ou d'anhydride d'acide sur
l'aniline).
- Action d'un
chlorure d'acide
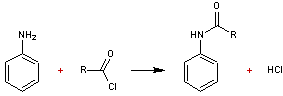
- Action d'un
anhydride d'acide
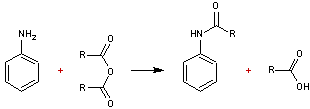
Dans
les deux cas on obtient un amide substitué sur l'azote par un groupement
aromatique (anilide).
Dans le
cas de l'aniline et du chlorure d'éthanoyle (première équation avec R-
correspondant à CH3-) on obtient le N-phényléthanamide ou
N-phénylacétamide ou acétanilide.
En
milieu acide on obtient la métanitraniline
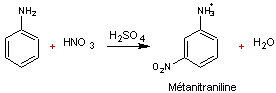
En effet -NH3+ oriente
la substitution en position méta.
Remarque
1 :
Dans
cette nitration, l'agent électrophile est l'ion nitronium NO2+.
En utilisant un mélange d'acide nitrique et d'acide sulfurique on a formation
de l'ion nitronium par la réaction suivante :
![]()
Cet
équilibre est déplacé vers la droite tout au long de la réaction car l'acide
sulfurique concentré fixe l'eau formée.
En
n'utilisant que l'acide nitrique, l'ion nitronium se forme lors de la réaction
équilibrée suivante :
![]()
L'eau
formée déplace l'équilibre vers la gauche (sens 2), la formation de l'ion
nitronium est arrêtée et la nitration cesse.
Remarque
2 :
Si l'on
veut l'isomère para il faut préalablement bloquer la fonction amine par
acylation :

11-
Sulfonation de l'aniline
A froid l'acide sulfurique donne une
réaction acido-basique avec l'aniline et formation d'un hydrogénosulfate
d'aniline.
A chaud il y a formation de l'acide
4-aminobenzènesulfonique ou acide sulfanilique.
12- Oxydations de l'aniline
L'aniline
s'oxyde facilement ; avec la plupart des oxydants (mélange sulfochromique,
trioxyde de chrome, hypochlorites), on obtient des composés de couleur rouge
foncé. Avec le chlorate de potassium KClO3, on obtient un colorant
noir, présentant une excellente résistance à la lumière, le noir d'aniline :

13) La polyaniline (PANi)
La méthémoglobine
|
|
|
|
Noyau hème |
Noyau hématine |
L’hémoglobine est une hétéroprotéine
dont le groupement prosthétique est un noyau hème formé de quatre groupes pyrroles (portant des substituants
sur les atomes de carbone non liés aux atomes d’azote) reliés entre eux
(structure d’une porphyrine)
et liés à un ion fer(II).
Si au lieu d'un ion Fer (II) c'est
un ion Fer(III) l'hème devient de l'hématine et l'hémoglobine de la
méthémoglobine.
Alors que le fer(II) de l’hème fixe
réversiblement le dioxygène de l’air, ce qui permet aux tissus de le récupérer,
le fer(III) de l’hématine fixe O2 de façon irréversible et la
méthémoglobine ne peut plus oxygéner les tissus.
La methémoglobinémie devient visible
(cyanose c'est-à-dire coloration bleue ou bleuâtre de la peau) dès 10%
d’hémoglobine transformée ; elle devient mortelle au-delà de 70%.