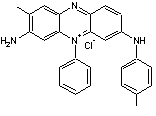
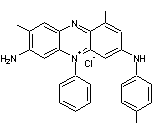
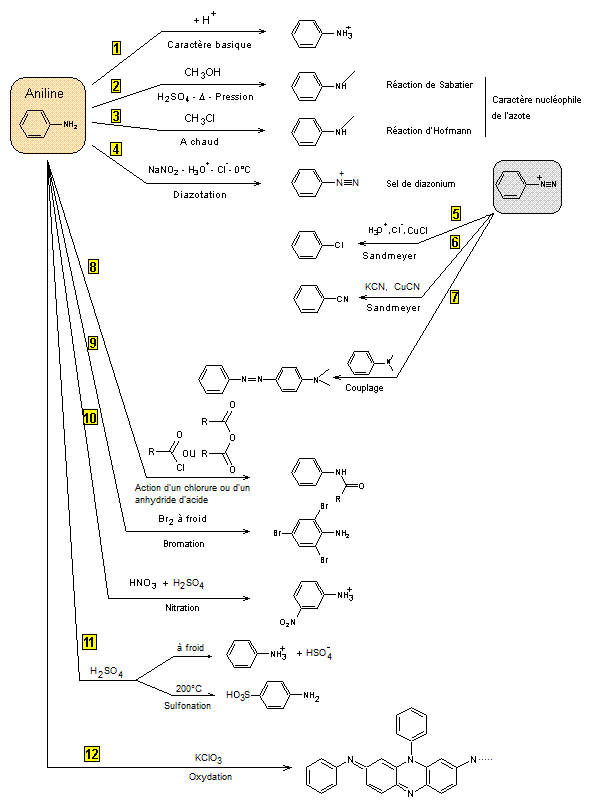
POLYANILINE
Plan de l'étude
1) L'aniline
1-1) Historique
1-2) Préparation
1-3)
Propriétés physiques
1-4)
Propriétés chimiques
2) Polyaniline
2-1)
Polymère conducteur électronique
2-2)
Applications
2-2-1)
En tant que conducteur électrique
2-2-2)
Applications utilisant le processus de dopage et
dédopage
2-2-3)
Applications à l'état non dopé
2-2-4)
Propriétés optiques
Annexe 1 La
méthémoglobine
Annexe 2 Couleurs
complémentaires
1) L'aniline
1-1) Historique
Trois
scientifiques allemands sont à l'origine de la découverte de l'aniline :
![]()
- Otto Unverdorben un pharmacien qui en 1826 isole une
nouvelle espèce chimique, à laquelle il donne le nom de "Krystalline",
à partir d'une distillation sèche de l'indigo :
- Friedlieb Ferdinand Runge, ingénieur chimiste à
Oranienbourg (près de Berlin) qui en 1834 obtient la même espèce à partir
des goudrons de houille ; une espèce basique qu'il appelle cyanol à cause
de sa légère coloration bleue en présence de composés chlorés.
- Carl Julius von Fritzsche, un chimiste, qui en 1840
prépare à nouveau cette molécule en faisant réagir de l’indigo avec de la
potasse ; l’indigo étant extrait de la plante Indigofera anil, il
donne le nom d’aniline à ce nouveau composé organique.
Il faut,
pour compléter ce tour d'horizon des savants qui ont approché l'aniline au
moment de sa découverte, signaler :
v
Nicolaï Zinin Professeur à Kazan et à
St Pétersbourg qui montre en 1842 que l'aniline peut être préparée par
réduction du nitrobenzène.
v
August Wilhelm von Hofmann qui prépare
en 1856 un beau colorant, le rouge d'aniline en faisant agir du tétrachlorure
de carbone sur de l'aniline brute (contenant aussi de la toluidine).
v
William Henry Perkin senior, un élève
de Hofmann, qui devient le fondateur réel de l'industrie des colorants à
l'aniline grâce à sa "mauvéine" un colorant mauve qu'il obtient en
1856 par oxydation de l'aniline brute (Il
s'agit en fait d'un composé se formant à partir des trois molécules aniline,
ortho-toluidine et para-toluidine oxydées en milieu sulfurique par le
dichromate de potassium. Il se forme d'ailleurs deux composés, la mauvéine A et
une autre molécule ayant un groupement méthyle en plus, la mauvéine B).
|
|
|
|
Mauvéine A |
Mauvéine B |
"Le
6 avril 1865, l'ancien joaillier et fabricant de gaz d'éclairage Friedrich
Engelhorn fonda à Mannheim la Badische Anilin & Sodafabrik (BASF) ;
en raison de difficultés survenues dans l'acquisition du terrain nécessaire à
la construction de l'usine, celle-ci fut finalement bâtie la même année sur la
rive opposée, la rive gauche du Rhin à Ludwigshafen (en territoire bavarois) ;
elle devint l'une des plus grandes entreprises industrielles."
(Extrait de
"Histoire de la chimie" par G. Lockemann – Dunod – 1962)
L’aniline
est alors largement utilisée à l’échelle industrielle pour la production de
colorants, comme la fuchsine.
Ces
colorants seront rapidement supplantés par un nouveau type de molécules, les
colorants azoïques, obtenus à partir d’aniline par des réactions de
diazotation, comme par exemple le jaune de méthyle
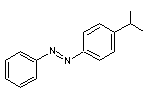
1-2) Préparation
Aujourd’hui,
l’aniline reste un composé organique de première importance. Elle est préparée
par réduction du nitrobenzène (réduction de Béchamp).
![]()
![]()
ou
(mais plus rarement) par action d’ammoniac sur le chlorobenzène.
![]()
1-3) Propriétés
physiques
C'est
un liquide huileux, incolore quand il vient d'être distillé, mais qui brunit à
l'air et à la lumière. Il possède une odeur caractéristique désagréable, tout à
fait différente de celle des amines
aliphatiques.
|
Masse molaire |
T de fusion |
T d'ébullition |
Densité |
Indice de réfraction |
|
93,13 g.mol-1 |
-6,2°C |
184,32°C |
1,0216 |
1,5863 |
|
|
|
|
|
|
|
Solubilité |
Azéotrope eau-aniline |
Risques |
pKa |
|
|
Eau: 34g.L-1 à 20°C éthanol,éther,benzène |
Composition: 19,2% d'aniline (en masse). |
Toxique (R: 20/21/22-40-48/23/24/25 S: 28-36/37/44) |
4,6 à 25°C |
|
1-4) Propriétés
chimiques
Résumons
les principales propriétés chimiques de l'aniline (voir le détail des réactions)
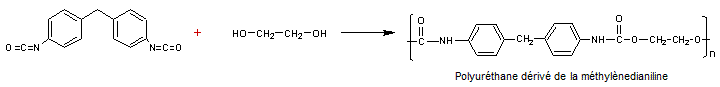
La plus
grosse partie du tonnage d'aniline produit est utilisée dans la chimie des
polymères, en particulier pour la préparation de méthylènedianiline, un
précurseur des polyuréthanes
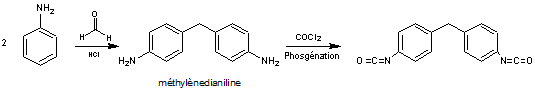
Les
colorants noirs à base d’aniline comme le noir d'aniline dont la composition
est complexe et dont on peut donner l'un des motifs
sont
encore employés pour la teinture des cuirs, dans les encres d’imprimerie ou
pour le marquage du linge.
L’aniline
reste utilisée dans le procédé de vulcanisation des caoutchoucs où elle joue le
rôle d'accélérateur de vulcanisation en réduisant la durée de chauffage
nécessaire et en améliorant la qualité du produit.
Dans le
domaine pharmaceutique on l'utilise pour la conception d’agents bactéricides
tels que les dérivés du sulfanilamide
![]()
Risques
lors de son utilisation
- Il est combustible et explosif
lorsqu'il est mis en contact avec l'acide perchlorique ou le méthanal
|
|
|
|
Acide
perchlorique |
Méthanal |
- Il s'enflamme aussi spontanément lorsqu'il
est mis en contact avec l'acide nitrique (HNO3) fumant ou les
peroxydes de sodium ou de potassium.
|
|
|
|
Peroxyde
de sodium |
Peroxyde
de potassium |
- Il s'oxyde de façon violente avec
le peroxyde d'hydrogène (H2O2), le chlorate de sodium
(NaClO3), l'acide chromique (H2CrO4) ou
l'acide hypochloreux (HClO).
- L'exposition à l'aniline engendre la
méthémoglobine (voir annexe 1).
2) Polyaniline
Depuis
quelques années, l’aniline connait un renouveau dans le domaine des matériaux
innovants. En effet, en polymérisant l’aniline, on obtient un polymère
conducteur.
2-1) Polymère
conducteur électronique
Utilisé
comme monomère, la molécule d'aniline conduit à la formation d'un polymère
conjugué : la polyaniline ou PANi de structure générale :
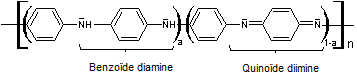
La polyaniline
résulte de la polymérisation de radicaux de l'aniline formés par oxydation du
monomère.
- Pour a = 1, le PANi
est sous sa forme la plus réduite appelée leucoéméraldine base, notée
LB, solide incolore ou jaune pâle qui s'oxyde à l'air.
|
|
ou
bien |
- Pour a = 0, le PANi
est sous sa forme la plus oxydée appelée pernigraniline base, notée PB,
solide violet.
![]()
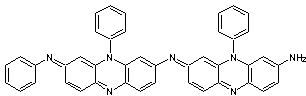
- Pour a = 0,5, le PANi
est sous une forme appelée éméraldine base, notée EB, de couleur
bleue.
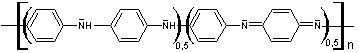
Sous
chacune des trois formes LB,PB,EB, la polyaniline est un isolant électrique. Ce
qui en fait son intérêt, c'est qu'il peut être rendu conducteur par dopage.
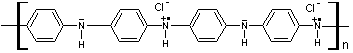
La
forme dopée et conductrice du PANi est obtenue par traitement de la forme EB
(éméraldine base) par un acide fort, comme l'acide chlorhydrique, qui conduit à
une protonation des sites imine suivi d'un réarrangement interne de la chaîne
polymère pour une meilleure répartition des charges. Cette nouvelle forme du
polyaniline, représentée ci-dessous est la seule conductrice. Elle est de
couleur verte ; elle est appelée éméraldine sel, notée ES, c'est
un réseau polaronique.
Remarque 1 :
Il y a
un défaut d'électrons au niveau des atomes d'azote donc il s'agit d'un dopage
de type p.
Remarque
2 :
La
forme bleue EB n'est pas dopée donc le gap à franchir par les électrons est
plus grand que dans la forme verte ES. La longueur d'onde absorbée par la forme
EB est donc plus petite que celle absorbée par la forme ES, cela est conforme
aux couleurs observées (voir
annexe 2).
La
forme ES conductrice peut être préparée par voie électrochimique :
On
utilise un montage à trois électrodes : une électrode de travail en platine de surface
22 cm2 où se déposera le polymère vert préparé, une contre-électrode
en platine et une électrode au calomel saturée comme électrode de référence. Le
montage est complété par un générateur de courant, un voltmètre et un
ampèremètre. Les électrodes sont plongées dans une cellule contenant de l’acide
chlorhydrique molaire et de l’aniline à une concentration de l’ordre de 0,1
mol·L-1. Après amorçage de la réaction de polymérisation, le
générateur est réglé de façon à obtenir une densité de courant de 46 A·m-2.
La tension reste stable à 850 mV pendant 1 h puis diminue brusquement,
signalant la fin de la synthèse. La masse de polymère obtenue est de 96 mg.
La
réaction d'oxydation de l'aniline en présence d'acide chlorhydrique, et
conduisant à la forme ES du polyaniline est la suivante :

2-2) Applications
Le
polymère PANi présente une grande souplesse d'utilisation grâce à son dopage
protonique. Un grand nombre d'acides peut être utilisé, certains qui en plus
d'être dopants, peuvent être plastifiants ou agents de solubilisation du
polymère dans les solvants usuels.
2-2-1) En tant que conducteur électrique (polymère dopé) :
- Textile
antistatique
Le
dépôt d'un film polymère de PANi sur différents tissus a été étudié dans le but
de mettre au point des nouveaux textiles
dits intelligents.
Le
polymère est mélangé à de la colle et déposé sur un textile en coton et sur un
textile en polyester.
On
s'aperçoit que le PANi rend le textile conducteur que son dépôt ait lieu sur
une fibre naturelle (coton) ou sur une fibre synthétique (polyester).
Ce
textile ne permet donc pas une accumulation des charges électrostatiques.
- Peintures,
encres, adhésifs, conducteurs
Peintures
conductrices
:
Elles
sont utilisées
* Pour décharger des surfaces ou des
outils de leurs charges électrostatiques.
* Pour créer des circuits simples
qui peuvent commander des interrupteurs ou des signaux.
* Pour galvaniser des surfaces qui
ne pourraient sans ça être traitées ; elles permettent ainsi la pose de
revêtements anticorrosion.
Encres
conductrices
:
Elles
permettent d'imprimer des circuits électroniques sur différents types de
matériaux.
Elles
sont notamment utilisées pour les systèmes RFID (Radio Frequency
IDentification) méthode permettant la récupération des données à distance.
On
commence à les utiliser pour des tatouages invisibles qui changent de couleur
par exemple avec l'augmentation de la température du corps ou l'augmentation du
taux de sucre dans les liquides intersticiels.
Adhésifs
conducteurs
:
Ils se
prêtent aux interconnexions électriques et aux collages structuraux afin
d'obtenir une meilleure fiabilité des systèmes électroniques utilisés notamment
dans les équipements automobiles.
2-2-2) Applications utilisant le processus de dopage et dédopage
:
- Capteur
de gaz
Le PANi
peut être utilisé comme couche sensible d'un capteur détectant par exemple la
présence de NH3 gazeux ; en effet l'ammoniac est une base, elle
réagira avec l'acide chlorhydrique contenu dans la forme dopée du PANi. On
observera alors un passage de la forme ES à la forme EB du polyaniline en
présence d'ammoniac. Cela se traduira par un changement de couleur ou par une
diminution de la conductivité du film sensible.
On peut
ainsi grâce à des capteurs dédiés détecter, outre l'ammoniac gazeux, différents
autres gaz comme CO2, NO2, CO, Cl2, O3
et les COV.
- Capteur
d'humidité, de pH, de vitamine C
De la
même façon, toujours en jouant sur une variation de couleur ou de conductivité
on peut construire des capteurs d'humidité, de pH et même de vitamine C.
- Batteries
organiques rechargeables
Le PANi
participe au fonctionnement de certaines batteries organiques rechargeables.
2-2-3) Applications à l'état non dopé :
Dans
cet état le PANi a des propriétés semi-conductrices.
On
l'utilise pour construire
- Des cellules photovoltaïques organiques
- Des OLED
- On lit dans
l'article "Etude
du comportement chiroptique de polyaniline optiquement active synthétisée à
partir d'acides aminés d'origine naturelle" (fre.legatechnics.com)
" Les polymères
électroactifs et intrinsèquement conducteurs tels que le polypyrrole, le
polythiophène et la polyaniline (PANI), entre autres, sont des semi-conducteurs
organiques. Lorsque l'hélicité est induite dans ces polymères conducteurs, ils
sont d'une grande utilité dans les dispositifs d'électroluminescence à
polarisation circulaire, électrodes à modification chirale, analyses
stéréosélectives pour le transport sélectif d'énantiomères, ……. électrodes pour
la reconnaissance énantiosélective ….
Les
sels de polyaniline-éméraldine optiquement actifs peuvent être préparés par
polymérisation électrochimique ou par dopage de la base éméraldine (EB) dans
des solvants organiques avec des agents chiraux."
- Alors que
des piles peuvent être réalisées avec 2 systèmes rédox différents ou bien avec
un seul système rédox mais avec des concentrations différentes à chaque
électrode (piles à concentration), des travaux sont actuellement menés pour
mettre au point des piles dont la substance "active" serait la même à
chaque électrode, la différence étant que d'un côté on aurait cette substance
constituée d'un énantiomère et l'autre électrode serait constituée de l'autre
énantiomère. Par référence au fait que deux énantiomères sont images l'un de
l'autre dans un miroir, on donne quelquefois à ces dispositifs le nom de
"piles miroirs".
Des
électrodes comportant du PANi pourraient être mises en oeuvre dans ces
recherches.
- On trouve
dans la littérature (Thèse de Wahid ULLAH "Synthèse
électrochimiques de nanoréseaux métalliques et polymériques au travers de films
minces de silice mésoporeuse à canaux verticalement orientés) comment réaliser des
réseaux de nanofils de polyaniline (PANi) sur des électrodes d'ITO (Oxyde mixte
d'indium et d'étain) :
Schéma
de principe
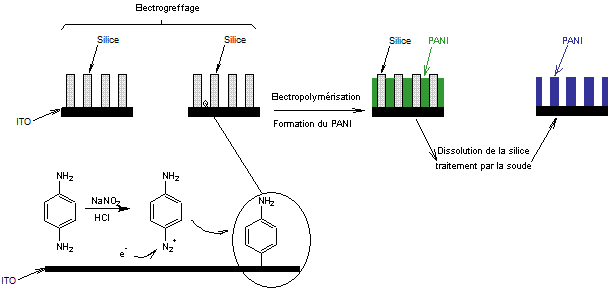
Sur un
gabarit correspondant à une base d'ITO sur laquelle sont placés des fils de
silice mésoporeuse, on procède successivement à
- Un électrogreffage d'aniline par
réduction d'un sel de diazonium porteur d'une fonction amine. La fixation de
ces molécules a lieu au fond de canaux mésoporeux de la silice.
- Une électropolymérisation de
l'aniline pour obtenir des réseaux verticaux de nanofils de PANi.
- Dissolution du gabarit de silice
dans une solution de soude.
Remarque :
La
silice mésoporeuse correspond à un nanomatériau qui présente un réseau organisé
de canaux, de taille de pore variable (de quelques nanomètres à quelques dizaines
de nanomètres). La surface de ces canaux est très grande et ce matériau
présente un grand intérêt notamment en catalyse.
Annexe 1
La méthémoglobine
|
|
|
|
Noyau hème |
Noyau
hématine |
L’hémoglobine est une hétéroprotéine dont le
groupement prosthétique est un noyau hème formé de quatre groupes pyrroles (portant des substituants sur les atomes de
carbone non liés aux atomes d’azote) reliés entre eux (structure d’une porphyrine) et liés à un ion fer(II).
Si au lieu d'un ion Fer (II) c'est un ion Fer(III)
l'hème devient de l'hématine et l'hémoglobine de la méthémoglobine.
Alors que le fer(II) de l’hème fixe réversiblement le
dioxygène de l’air, ce qui permet aux tissus de le récupérer, le fer(III) de
l’hématine fixe O2 de façon irréversible et la méthémoglobine ne
peut plus oxygéner les tissus.
La methémoglobinémie devient visible (cyanose
c'est-à-dire coloration bleue ou bleuâtre de la peau) dès 10% d’hémoglobine
transformée ; elle devient mortelle au-delà de 70%.
Annexe 2
Couleurs complémentaires
La forme EB du polyaniline nous
apparait bleue. Cela signifie que la couleur absorbée par cette substance est
l'orangé, couleur complémentaire du bleu.
La forme ES du polyaniline nous
apparait verte. Cela signifie que la couleur absorbée par cette substance est
le rouge, couleur complémentaire du vert.
Les couleurs absorbées nous
renseignent sur l'importance de l'énergie nécessaire aux électrons pour
franchir le "gap" (intervalle entre la bande de valence et la bande
de conduction).
L'énergie nécessaire aux électrons dans
le cas de la forme EB est plus grande que celle nécessaire aux électrons de la
forme ES ; en effet λorangé < λrouge
donc
en ce qui concerne l'énergie νorangé > νrouge et hνorangé >
hνrouge .
Cela correspond bien à notre
raisonnement.