NITRATES
NITRITES ET METHEMOGLOBINE
1) Des nitrates aux nitrites et à la methémoglobine :
Les ions nitrates (NO3-) et les ions
nitrites (NO2-) ont des formules voisines mais des
propriétés très différentes ; l’ion nitrate est stable, l’ion nitrite
beaucoup moins et cette aptitude à réagir facilement explique sa toxicité.
En effet l’ion nitrite peut par exemple dans l’organisme
oxyder l’ion fer (II) du noyau hème de l’hémoglobine en ion fer (III),
empêchant celle-ci de jouer son rôle capital dans les échanges respiratoires
(fixation du dioxygène au niveau des poumons et libération au niveau des
tissus).
L’hémoglobine est une hétéroprotéine dont le groupement
prosthétique est un noyau hème formé de quatre groupes pyrroles (portant des substituants
sur les atomes de carbone non liés aux atomes d’azote) reliés entre eux
(structure d’une porphyrine)
et liés à un ion fer(II) :

Noyau hème
Si celui-ci est oxydé en fer(III), le noyau hème devient un
noyau hématine et l’hémoglobine de
la methémoglobine.

Noyau hématine
Alors que le fer(II) de l’hème fixe réversiblement le
dioxygène de l’air,
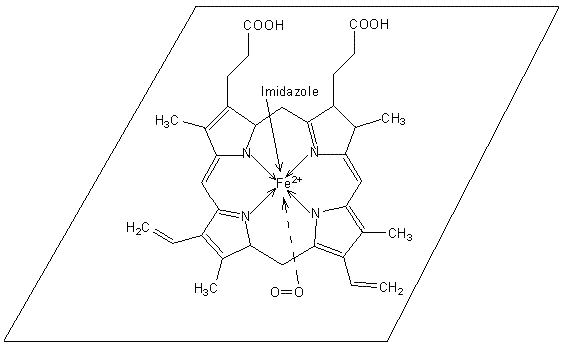
ce qui permet aux tissus de le récupérer, le fer(III) de
l’hématine fixe O2 de façon irréversible et la methémoglobine ne
peut plus oxygéner les tissus.
La methémoglobinémie devient visible (cyanose c'est-à-dire coloration
bleue ou bleuâtre de la peau) dès 10% d’hémoglobine transformée ; elle
devient mortelle au-delà de 70%.
C’est chez le nourrisson que le risque d’intoxication par les
nitrites est le plus important. L’absorption directe des nitrites n’est d’ailleurs
pas le seul facteur de risque chez le bébé, une absorption trop importante de
nitrates peut produire le même effet.
Pourtant les nitrates en tant que tels ne sont pas toxiques,
mais ils peuvent se transformer en nitrites par réduction dans l’organisme dans
des conditions favorables. Le couple NO3-/NO2-
(E0 = 0,94V) a comme demi-équation redox :
![]()
Cette transformation fait partie du métabolisme des
plantes ; elle se produit sous l’effet d’une enzyme : la nitrate
réductase qui n’existe pas chez les animaux. Certaines bactéries cependant à
des pH de l’ordre de 6-6,5 peuvent aussi réduire les nitrates en nitrites. Chez
l’adulte cela peut arriver au niveau de la bouche (ou le pH peut avoir ces
valeurs) mais pas dans le tube digestif où le pH est généralement (sauf cas
pathologiques) très différent. Par contre cela peut arriver chez le bébé qui a
une flore nitritogène plus importante que l’adulte et qui dans les premiers
jours de sa vie, ne secrétant pas d’acide chlorhydrique au niveau de son
estomac, a un pH gastrique voisin de la neutralité.
Il faut savoir qu’un homme en bonne santé a normalement dans
son organisme moins de 1% de methémoglobine, ce taux étant régulé par des
systèmes enzymatiques réducteurs qui transforment le fer(III) en fer(II).
2) Pourquoi des nitrites dans les aliments ?
- Conservateurs :
On utilise les nitrites comme conservateurs dans l’industrie
agro-alimentaire ; dans des conditions de milieu favorables les nitrites
peuvent oxyder les microorganismes au sein même de leurs cellules en produisant
du monoxyde d’azote NO qui bloque leur développement. La demi-équation rédox du
couple NO2-/NO (E0 = 0,98V) est la suivante :
![]()
- Colorant des produits
carnés : Les muscles contiennent une hétéroprotéine, la myoglobine,
dont le groupement prosthétique est le même que celui de l’hémoglobine :
le noyau hème. En oxydant le fer(II) de ce noyau en fer(III) l’ion nitrite se
transforme en monoxyde d’azote et il se forme de la nitrosomyoglobine pigment
stable qui colore la viande crue conservée par des nitrites. Lorsqu’on fait
cuire cette viande, il se forme un autre pigment : le nitrosomyochromogène
qui donne notamment à la charcuterie cuite sa couleur rose caractéristique.
- Agent de sapidité :
les nitrites peuvent réagir sur les amines secondaires en donnant des
nitrosamines. En transformant les amines ils font disparaître leur odeur
(généralement désagréable) et contribuent à modifier favorablement la saveur
des aliments.
3) Nitrites et cancers :
Les
nitrosamines qui se forment par action des nitrites sur les amines sont de
puissants agents cancérogènes lorsqu’ils sont testés chez les animaux (tumeurs
du foie, des reins, de l’œsophage, du pancréas…). Chez l’homme on a constaté
une relation entre la consommation de charcuteries de montagne riches en
nitrosamines et les cancers du pancréas.
Pourquoi dans ces conditions continuer à accepter nitrates (E
251, E252) et nitrites (E250) dans l’industrie agro-alimentaire ? La
réponse est que ce sont les seuls conservateurs connus capables d’empêcher le développement
de la bactérie qui provoque le botulisme, une intoxication mortelle.
Signalons pour terminer que des nitrates et parfois des nitrites se trouvent dans certaines eaux.
L’OMS a fixé à 50 mg/L la concentration maximale de nitrates admissible dans
une eau potable.