OPIUM, OPIACES, OPIOÏDES
Gérard GOMEZ
Plan de l'étude
2) Les opiacés
2-1) Définition
2-2) Action
médicamenteuse des opiacés
2-3) Mécanisme
d'action des opiacés
3) Les opioïdes
4)
Tableau récapitulatif des opiacés et opioïdes cités
5)
La chimie médicinale au service du traitement de la douleur
5-1)
Molécules endogènes pour le traitement de la douleur
5-2)
Biosynthèse d'une molécule naturelle exogène pour bloquer
les récepteurs de la douleur
1) Le pavot, l'opium :
|
|
|
Le pavot à opium (Papaver somniferum) de la famille des
papavéracées est une plante dicotylédone, annuelle, de hauteur maximale 1,30 m,
à feuilles lobées, dentées, dont les grandes fleurs sont formées de deux
sépales caducs, quatre pétales chiffonnés dans le bouton, de nombreuses
étamines et un pistil caractéristique. Son fruit forme une capsule renflée,
cloisonnée intérieurement, aplatie sur le dessus ; à maturité il libère de
toutes petites graines en s'ouvrant. On utilise ces graines lors de la
confection de certains pains, de certains gâteaux ainsi que pour des mélanges
destinés aux oiseaux ; en pressant ces graines à froid on extrait une huile
alimentaire claire, appelée huile d'oeillette ; une
seconde pression à chaud donne une huile utilisée en peinture (siccatif). Le latex, suc épaissi et
concret recueilli par incision des capsules non mûres, constitue l'opium et
contient un certains nombre d'alcaloïdes (un alcaloïde est une substance azotée à caractère basique, à molécule
presque toujours hétérocyclique (l'azote étant dans le cycle) dont l'activité
physiologique et pharmacologique est souvent marquée) qui n'existent pas dans les graines. Le pavot à opium n'existe
pas à l'état sauvage, c'est un cultivar. Son origine géographique
est mal connue, mais il a subi des migrations d'ouest en est et les arabes
ont été les principaux vecteurs de la plante et de ses usages. Actuellement
on le trouve dans le sud-est de l'Europe et au sud de l'Asie (Le croissant
d'or : Afghanistan, Iran, Pakistan et
le triangle d'or : Laos, Birmanie, Thaïlande
à l'est). |
|
L'histoire de l'opium,
indissociable du commerce de celui-ci, notamment entre la Chine et l'Europe
(et particulièrement l'Angleterre), est extrêmement intéressante et fournie.
La guerre de l'opium par exemple est le
nom donné au conflit qui opposa la Chine et l'Angleterre de 1839 à
1842 à la suite de l'interdiction formulée par la Chine à la compagnie des
Indes du commerce de l'opium. L'opium a été utilisé à
des fins thérapeutiques grâce à ses propriétés calmantes. Il a aussi été fumé
procurant une sensation de bien-être à l'utilisateur qui tombait rapidement
dans un état de dépendance. Au XIXème siècle les fumeries d'opium sont très
nombreuses en Chine, surtout dans les villes. En 1830 cela touche 12,5
millions de chinois et notamment l'élite du pays, provoquant une
déliquescence de la société. A cette époque, on
commence (notamment F.W.A.Sertürner)
à extraire les alcaloïdes du latex (morphine, codéine,….) et à les utiliser à
des fins thérapeutiques ; mais rapidement l'usage illicite se développe. " Le trafic international de drogue tel que
nous le connaissons aujourd'hui est le produit de cette longue genèse, au
cours de laquelle l'opium, notamment, est devenu, d'une drogue thérapeutique
licite, une marchandise illicite, dont la dynamique commerciale est
principalement basée sur le phénomène de dépendance des consommateurs.
L'expérience britannique en Chine représente en quelque sorte la première
pierre de l'édifice actuel du narcotrafic à laquelle de nombreux autres
acteurs, étatiques et non étatiques ont rajouté la leur…." (extrait
de "Les territoires de
l'opium" par Pierre-Arnaud Chouvy). |
||
2) Les opiacés :
2-1) Définition :
On appelle opiacé une
substance dérivée de l'opium ; elle est donc d'origine naturelle, même si elle a
été obtenue par hémisynthèse à partir de produits extraits de l'opium.
On
distingue :
- Parmi les molécules directement
présentes dans l'opium : la morphine, la codéine, la thébaïne, la papavéraldine, la papavérine,
la narcéine, la narcotine, la laudanosine…
- Parmi les molécules obtenues par
hémisynthèse à partir des précédentes : l'héroïne, l'hydromorphone, l'oxymorphone,
l'hydrocodone, l'oxycodone
….
2-2) Action médicamenteuse des opiacés :
Ils
peuvent avoir un effet narcotique ou hypnotique (c'est-à-dire qu'ils induisent le
sommeil),
ou un effet analgésique ou antalgique (ils atténuent ou suppriment la douleur) ou bien, comme pour
la morphine par exemple, les deux ; ils agissent dans tous les cas sur le
système nerveux central.
Parallèlement
à ces effets recherchés, on note d'autres effets tels que des dépressions
respiratoires, un myosis (diminution
du diamètre de la pupille par contraction de l'iris), la constipation et
pour certains d'entre eux des effets psychotropes (un psychotrope est une
substance qui, en altérant les fonctions du cerveau, induit des modifications de
fonctions psychologiques ou comportementales (perceptions, sensations, humeur….)) tels que euphorie
et effets psychodysleptiques, qui en font des stupéfiants, c'est-à-dire en
termes de loi, des substances propres à induire une dépendance et à poser des dangers
pour la santé publique ; leur utilisation est en conséquence très étroitement
réglementée.
2-3) Mécanisme d'action des opiacés :
Le mécanisme d'action précis des opiacés n'est
pas connu.
On
dénombre trois familles de récepteurs des opiacés, les récepteurs mu (µ), kappa (κ) et delta (d)
qui sont localisés dans diverses zones du système nerveux central (un récepteur est une
structure située à la surface d'une cellule et qui permet à des molécules
appropriées de se fixer ce qui déclenche une action spécifique sur la cellule).
- Les récepteurs µ situés dans la substance
grise et le thalamus notamment contribuent au contrôle de la douleur et de la respiration (mais aussi aux effets
de constipation de myosis et à l'euphorie).
- Les récepteurs κ situés dans
l'hypothalamus et la moelle épinière participent aux effets neuroendocriniens
et à l'analgésie spinale.
- Les récepteurs d
placés dans la moelle épinière contribuent à l'analgésie mais aussi à la
constipation, aux dépressions respiratoires modérées, au myosis et aux effets
psychodysleptiques.
La
différence entre les effets, induits par les différents opiacés sur l'organisme
s'explique par leur action plus ou moins importante sur ces différents
récepteurs.
3) Les opioïdes
:
On
peut définir un opioïde comme une substance qui ne répond pas à la définition
d'un opiacé mais qui peut quand même se lier à un récepteur des opiacés.
Cette
liaison peut entraîner soit une action tout à fait comparable à celle d'un
opiacé on dit alors que l'opioïde est un agoniste entier, soit une
action partiellement comparable à celle d'un opiacé, l'opioïde est alors
qualifié d'agoniste partiel ou agoniste/antagoniste. Cette liaison peut
aussi aboutir à bloquer le récepteur et l'empêcher d'être disponible pour un
opiacé, on qualifie alors l'opioïde d'antagoniste.
- Agonistes entiers : Méthadone, propoxyphène, péthidine….
Remarque :
Les
enképhalines, des pentapeptides isolées du
cerveau de divers mammifères (en 1974 par J.Hughes et H.W. Kosterlitz) ont une
activité analgésique analogue à celle de la morphine mais beaucoup plus fugace
; il en est de même de l'α et de la β-endorphine deux peptides de l'hypophyse
ayant respectivement 16 et 31 acides aminés (isolées en 1976 par C.K. Li et R.
Guillemin) ainsi que de la dynorphine, un peptide de 17 amino-acides, isolée en
1980 par A.Goldstein. Ces substances sont des opioïdes endogènes. Leur
découverte permet de comprendre pourquoi les récepteurs des opiacés existent
dans l'organisme.
- Agonistes/antagonistes : ce
sont des produits pouvant être agonistes d'un type de récepteur et antagoniste
d'un autre : la nalbuphine et la nalorphine
sont des agonistes des récepteurs κ et antagonistes des récepteurs μ
; la buprénorphine est un agoniste partiel des
récepteurs μ et antagoniste des récepteurs κ.
- Antagonistes : la naloxone et la naltrexone sont
deux antagonistes non sélectifs des récepteurs des opiacés, ils bloquent les
trois types de récepteurs de la même façon.
Remarque : Certains auteurs font
du terme opioïde un terme très général "substance pouvant se lier aux
récepteurs des opiacés"….les opiacés formant alors un sous ensemble des
opioïdes.
4) Tableau
récapitulatif des opiacés et opioïdes cités :
Buprénorphine, Codéine, Héroïne, Hydrocodone, Hydromorphone, Laudanosine,
Méthadone, Morphine, Nalbuphine, Nalorphine, Naloxone, Naltrexone, Narcéine, Narcotine, Oxycodone, Oxymorphone, Papavéraldine, Papavérine, Péthidine, Propoxyphène, Thébaïne,
|
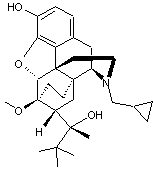
ou (2S)-2-[(-)-(5R,6R,7R,14S)-17-cyclopropylméthyl-4,5-époxy-3-hydroxy-6-méthoxy-6,14-éthanomorphinan-7-yl]-3,3-diméthylbutan-2-ol. C29H41NO4
Cristaux
blancs. Masse
molaire : 467,6401g.mol-1
N°
CAS
: 52485-79-7 |
|
Opioïde
de type agoniste/antagoniste ; agoniste partiel des récepteurs μ et
antagoniste des récepteurs κ. Principe
actif de médicaments utilisés comme antalgiques à faible dosage (Temgésic®)
et comme traitements substitutifs aux opiacés (Subutex®) à dosage plus
important. En
association avec la naloxone elle constitue le principe
actif d'un traitement substitutif aux opiacées (Suboxone ®). |
||||
|
Codéine ou (5R,6S)-7,8-didéhydro-4,5-époxy-3-méthoxy-17-méthylmorphinan-6-ol. Cristaux
orthorhombiques (lorsque recristallisé dans l'eau, l'éthanol dilué, l'éther). Masse
molaire : 299,365g.mol-1 N°
CAS
: 76-57-3 |
|
Alcaloïde de l'opium (opiacé),
antalgique et sédatif. |
||||
|
ou Diacétylmorphine ou diéthanoate de (5α,6α)-7,8-didéhydro-4,5-époxy-17-méthylmorphinane-3,6-diol. C21H23NO5 Masse
molaire
: Densité : 1,56
(à 25°C) |
La synthèse de ce dérivé de la morphine, autrefois utilisé
contre l'asthme ou la tuberculose, a été pour la première fois réalisée à
partir de la morphine extraite du pavot à opium par Alder Wright à Londres,
puis mise au point par l'entreprise Bayer en 1898 ; le produit est baptisé en
Allemagne "Heroin" par référence au grec hêrôs (êtres ayant
accompli des exploits et, de ce fait divinisés (demi-dieux)) en sachant que
heroisch avait au moyen-âge le sens de fort, puissant. La forme française
héroïne est attestée depuis 1904
(d'après Kerndeutsch de Paul Laveau - Edition Ellipses). |
Opiacé
dérivé d’un alcaloïde : la morphine.
C’est une drogue entraînant une dépendance physiologique et psychologique.
|
||||
|
Hydrocodone ou ou (5R,9R,13S,14R)-3-méthoxy-17-méthyl-4,5-époxymorphinan-6-one. C18H21NO3 Masse
molaire
: 299,365
g.mol-1 Fusion : 198°C N°
CAS
: 125-29-1 Solubilité : Soluble
dans l'éthanol ; insoluble dans l'eau. |
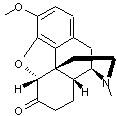
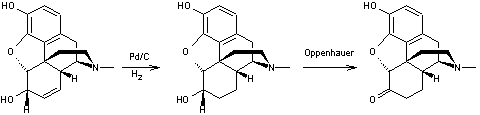
Dihydrocodéinone Isomère de la codéine ; cette molécule diffère de celle de
la codéine par la présence sur le carbone 6 d'une fonction cétone au lieu
d'une fonction alcool et par l'absence de double liaison entre les carbones 7
et 8. C'est un composé semi-synthétique obtenu à partir de la
codéine : - soit par chauffage
à reflux d'une solution alcoolique ou d'une solution aqueuse (acide) de
codéine en présence de catalyseur (Pd ou Pt), il s'ensuit un réarrangement ; - soit par réduction (hydrogénation catalytique) de la
double liaison en 7-8 de la molécule de codéine suivie par une oxydation par
la benzophénone en présence de tertiobutylate d'aluminium (oxydation d'Oppenauer).
Codéine Passage de la codéine à la dihydrocodéinone
|
Antitussif
semi-synthétique et analgésique aux actions semblables de façon qualitative à
celles de la codéine ; son action contre la toux est environ
trois fois plus puissante à poids égal que celle de la codéine. Le
mécanisme d'action précis de la dihydrocodéine et des autres opiacés n'est
pas connu. |
||||
|
ou 7,8-dihydromorphin-6-one ou 4,5α-époxy-3-hydroxy-17-méthylmorphinane-6-one. C17H19NO3 Aspect : Cristaux
(recristallisée dans l'éthanol). Masse
molaire
: 285,338
g.mol-1 Fusion : 266,5°C N°
CAS
: 466-99-9 |
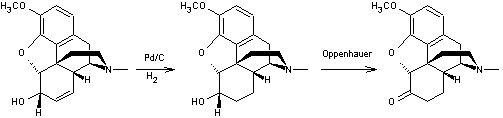
Hydromorphone Isomère de la morphine ; cette molécule diffère de celle de
la morphine par la présence sur le carbone 6 d'une fonction cétone au lieu
d'une fonction alcool et par l'absence de double liaison entre les carbones 7
et 8. C'est un composé semi-synthétique obtenu à partir de la
morphine : - soit par chauffage
à reflux d'une solution alcoolique ou d'une solution aqueuse (acide) de
morphine en présence de catalyseur (Pd ou Pt), il s'ensuit un réarrangement ; - soit par réduction (hydrogénation catalytique) de la
double liaison en 7-8 de la molécule de morphine suivie par une oxydation par
la benzophénone en présence de tertiobutylate d'aluminium (oxydation d'Oppenauer).
Morphine Passage de la morphine à l'hydromorphone
|
L'effet
narcotique de cet opiacé est environ cinq à sept fois supérieur à celui de la
morphine à poids égal. Il sert d'analgésique et c'est le plus puissant
antitussif connu. L'efficacité
de l'hydrocodéine comme antitussif est due au fait que le foie transforme
cette molécule en hydromorphine. Ce
médicament découvert et étudié en Allemagne entre 1924 et 1926 est
commercialisé dans le monde sous les noms : Dilaudid®, Palladone®, Opidol®,
Hydromorphane®… |
||||
|
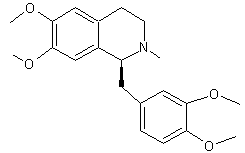
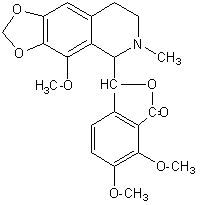
ou N-méthyl-1,2,3,4-tétrahydropapavérine ou 1-[(3,4-diméthoxyphényl)méthyl]-6,7-diméthoxy-2-méthyl-3,4-dihydro-1H-isoquinoléine. C21H27NO4 Masse molaire : 357,4434 g;mol-1 Fusion : 89°C Ebullition : 468,1°C Densité : 1,111 N° CAS : 2688-77-9 |
|
Molécule existant dans l’opium en petite quantité. C’est un alcaloïde benzylisoquinoléinique qui interagit avec les récepteurs GABA, les
récepteurs des opiacés et les récepteurs de l’acétylcholine (comme la
nicotine) et produit des convulsions de type tétanique. |
||||
|
Méthadone (racémique) C21H27NO Aspect : Cristaux blancs. Masse molaire : 309,445 g.mol-1 99,5 °C Très soluble dans l'éthanol. N° CAS : 76-99-3 |
|
Analgésique central aux
propriétés voisines de celles de la morphine. Cette
molécule est utilisée dans la désintoxication des toxicomanes. |
||||
|
ou 17-méthyl-7,8-didéhydro-4,5α-époxymorphinan-3,6α-diol.
285,338 g.mol-1 255 °C Sublimation à 190 °C |
|
Ce nom vient de Morphée, Dieu
des songes, fils de la nuit et du sommeil. |
||||
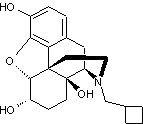
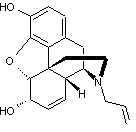
|
ou (-)17-cyclobutylméthyl-4,5α-époxymorphinane-3,6α,14-triol. C21H27NO4 357,4434 g.mol-1 230 °C 1,44 Soluble dans l'éthanol ; légèrement soluble dans
l'eau. N° CAS : 20594-83-6 |
|
Opioïde antalgique de type
agoniste/ antagoniste ; La nalbuphine est agoniste pour le récepteur κ
et antagoniste pour le récepteur µ. L'action analgésique de cette
molécule est équivalente à celle de la morphine. |
||||
|
ou Acétorphine ou (5α,
6α)-17-allyl-7,8-didéhydro-4,5-époxymorphinan-3,6-diol C19H21NO3 Cristaux quand recristallisé dans l'éther. Masse molaire : 311,375 g.mol-1 208 °C Soluble dans l'éthanol, l'acétone ; légèrement
soluble dans l'eau. N° CAS : 62-67-9 |
|
Opioïde de de type agoniste/
antagoniste ; La nalorphine est agoniste pour le récepteur κ et
antagoniste pour le récepteur µ. A été longtemps employé contre
les surdoses d'opiacés. |
||||
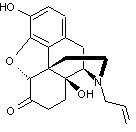
|
ou 17-allyl-4,5α-époxy-3,14-dihydroxymorphinan-6-one C19H21NO4
Cristaux (lorsque recristallisé dans l'éthanoate
d'éthyle). Masse molaire : 327,375 g.mol-1 178 °C Soluble dans le chloroforme ; insoluble dans
l'éther de pétrole. N° CAS : 465-65-6 |
|
Opioïde antagoniste non sélectif
des récepteurs des opiacés, il bloque les trois types de récepteurs de la
même façon. Elle est utilisée lors des
surdoses (intoxications morphiniques) ; en se plaçant sur les récepteurs
morphiniques elle empêche la morphine de se fixer et donc d'agir. Elle est utilisée dans le
traitement des dépressions respiratoires secondaires aux morphomimétiques en
fin d'intervention chirurgicale où à but thérapeutique ou diagnostique. En association avec la Buprénorphine, elle constitue le principe actif
d'un traitement substitutif aux opiacées (Suboxone ®). |
||||
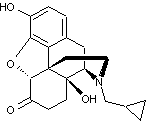
|
ou (5R,9R,13S,14S)-17-(cyclopropylméthyl)-4,5α-époxy-3,14-dihydroxy-morphinan-6-one. C20H23NO4 Cristaux (lorsque recristallisé dans l'acétone). Masse molaire : 341,402 g.mol-1 169 °C N° CAS : 16590-41-3 |
|
Opioïde antagoniste non sélectif
des récepteurs des opiacés, il bloque les trois types de récepteurs de la
même façon. Utilisé dans le traitement
"au long cours" des toxicomanies et de l'alcoolisme chronique. |
||||
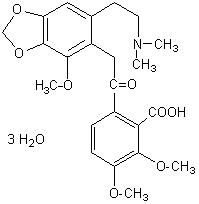
|
C23H27NO8, 3H2O.
|
|
Alcaloïde cristallin blanc non
hétérocyclique que l'on trouve dans l'opium. Il favorise le relâchement
musculaire. Il a été découvert par Pelletier en 1832. |
||||
|
α-Narcotine
C22H23NO7 |
|
Alcaloïde de l'opium, extrait du latex du pavot à opium, tout
comme la morphine,
la codéine,
la papavérine. Par oxydation la narcotine
conduit à l’acide opianique. |
||||
|
ou 4,5-α-époxy-14-hydroxy-3-méthoxy-17-méthyl-morphinan-6-one ou Dihydro-14-hydroxycodéinone C18H21NO4 Aspect : Cristaux blancs. Masse molaire : 315,365 g.mol-1 Fusion : 219°C N° CAS : 76-42-6 Solubilité : Soluble dans l'éthanol, le chloroforme ;
insoluble dans l'eau et l'éther. |
Oxycodone Cette molécule diffère de l'hydrocodone par un groupement
hydroxy en 14 présent dans la molécule d'oxycodone et absent de la molécule
d'hydrocodone.
Hydrocodone |
Opiacé dérivé de la codéine, à effet narcotique, analgésique et antitussif. Son effet analgésique est
environ deux fois supérieur à celui de la morphine. On peut l’obtenir aussi à partir
de la thébaïne. C'est un stupéfiant. |
||||
|
ou 14-hydroxydihydromorphinone C17H19NO4
Solide cristallisé Masse molaire : 301,337 g.mol-1
249 °C Densité : 1,503 76-41-5 |
Oxymorphone Cette molécule diffère de l'hydromorphone par un groupement
hydroxy en 14 présent dans la molécule d'oxymorphone et absent de la molécule
d'hydromorphone.
Hydromorphone |
Opiacé, analgésique, synthétisé
en Allemagne en 1914 et commercialisé depuis les années 1950 sous les noms
Opana ®, Numorphan ®, Numorphone ®. |
||||
|
C20H21NO4 Aspect : Aiguilles blanches quand elle est recristallisée
dans le chloroforme. Masse molaire : 339,386 g.mol-1 Fusion : 147,5°C Ebullition : Se sublime à 135°C Densité : 1,337 (à 20°C) Indice de réfraction : 1,625 (raie D du sodium) N° CAS : 58-74-2 Solubilité : Très soluble dans l’éthanol, le
chloroforme ; soluble dans l’acétone, le benzène, la pyridine ;
légèrement soluble dans l’eau. |
|
Alcaloïde de l'opium. Cette molécule a été extraite de l'opium pour la
première fois par Heinrich Emanuel Merck en 1848. |
||||
|
Se présente sous forme d’aiguilles lorsque
recristallisé dans l’éthanol. C20H19NO5 Masse molaire : 210,5°C Solubilité : Soluble dans le benzène et le chloroforme ;
légèrement soluble dans l’éthanol et dans l’éther ; insoluble dans
l’eau. ; N° CAS : 522-57-6 |
|
Alcaloïde tiré de l’opium
comme la papavérine dont elle ne diffère que par une
fonction cétone. |
||||
|
Péthidine Fusion : 30°C Ebullition : 155°C (sous 5 mm de Hg) N° CAS : 57-42-1 |
|
Médicament utilisé dans le
traitement de la douleur. Son mécanisme d'action analgésique est identique à
celui de la morphine. |
||||
|
Dextropropoxyphène (Darvon®) C22H29NO2 Cristaux (lorsque rectristallisé dans l'éther de
pétrole). Masse molaire : Fusion : 75,5°C N° CAS : 469-62-5 Lévopropoxyphène (Novrad®) C22H29NO2 Cristaux (lorsque rectristallisé dans l'éther de
pétrole). Masse molaire : Fusion : 75,5°C N° CAS : 2338-37-6 |
|
L'isomère (2S,3R) est le Darvon
(dextropropoxyphène), analgésique de la catégorie des opioïdes. |
||||
|
Thébaine Aspect : Lamelles
quand recristallisé dans l’éther. Masse
molaire : 311,375
g.mol-1 Fusion : 193°C Ebullition : Se
sublime à 91°C Densité : 1,305
(à 20°C) N°
CAS : 115-37-7 Solubilité : Très
soluble dans l’éthanol et le chloroforme ; soluble dans le
benzène ; légèrement soluble dans l’éther ; insoluble dans l’eau. |
|
Molécule voisine de la morphine et de la codéine, mais à
action euphorisante au lieu de calmante. N'a pas d'utilisation thérapeutique.
Elle a été découverte par Pelletier. |
5) La chimie
médicinale au service du traitement de la douleur (à partir du sujet de
chimie de l'agrégation externe de physique-chimie 2022 option chimie)
La
douleur serait à l’origine de près de deux tiers des consultations médicales.
C’est pourquoi elle est l’objet de nombreuses études, aussi bien fondamentales
que cliniques. Particulièrement active, cette recherche est indispensable pour
comprendre plus précisément les mécanismes en jeu dans la douleur et, ainsi,
permettre l’élaboration de nouveaux traitements.
Selon la définition officielle de l’Association internationale pour l’étude de
la douleur (IASP), "la douleur est une expérience sensorielle et
émotionnelle désagréable, associée à une lésion tissulaire réelle ou
potentielle, ou décrite dans ces termes". Il est néanmoins possible de
décrire le parcours de l’information douloureuse dans l’organisme, par exemple
la douleur aiguë provoquée par une coupure brûlante : (i) la brûlure stimule
des terminaisons nerveuses localisées au niveau de la peau ; (ii) l’information
se propage le long des nerfs nocicepteurs pour être transmise à la moelle
épinière au sein de laquelle un arc réflexe détermine le dégagement de la main
de la lame ; (iii) elle atteint ensuite le cerveau au niveau duquel le signal
est identifié comme une douleur. C’est au niveau du cerveau qu’interviennent
les premiers systèmes de modulation de la douleur grâce à la libération de
molécules opioïdes qui sont des peptides ou de petites protéines libérés au
niveau des terminaisons nerveuses après transport le long de l'axone.
5-1)
Molécules
endogènes pour le traitement de la douleur
En
1974, Hughes et Kosterlitz mettent en évidence que les enképhalines sont
capables de bloquer des récepteurs de la douleur au niveau du cerveau comme le
font la morphine et d’autres opiacés naturels ou synthétiques (codéine,
héroïne,...). Les enképhalines sont obtenues entre autres par le clivage d'une
protéine précurseur appelée proenképhaline.
Chaque proenképhaline contient au moins sept séquences de deux enképhalines :
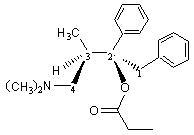
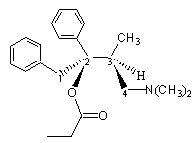
la Leu-enképhaline et la Met-enképhaline de formules respectives
H-Tyr-Gly-Gly-Phe-Leu-OH et H-Tyr-Gly-Gly-Phe-Met-OH. Les peptides sont écrits
par convention du coté N terminal vers le coté C terminal.
La
découverte des peptides opioïdes a permis de comprendre les mécanismes de
perception de la douleur et a incité les chimistes à développer des médicaments
peptidiques pour son traitement mais aussi des outils diagnostiques. Introduite
à partir des années 1950, la synthèse peptidique a mené à la découverte de
nombreuses hormones peptidiques et à leur production en grande quantité afin de
comprendre leurs mécanismes d’action. Les premières synthèses peptidiques ont
été réalisées en solution aqueuse. Elles ont ensuite été développées dans
d’autres solvants puis sur support polymère solide ou en solution.
Synthèse
de polypeptides sur support solide
En
1963, R.B. Merrifield a introduit une stratégie simple et ingénieuse pour la
synthèse des peptides : construire le peptide pas à pas sur un support
polymère. Révolutionnant la synthèse peptidique et permettant le développement
des peptides comme marqueurs biologiques et comme médicaments, il a obtenu le
prix Nobel de chimie en 1984 pour cette découverte. Le principe général de la
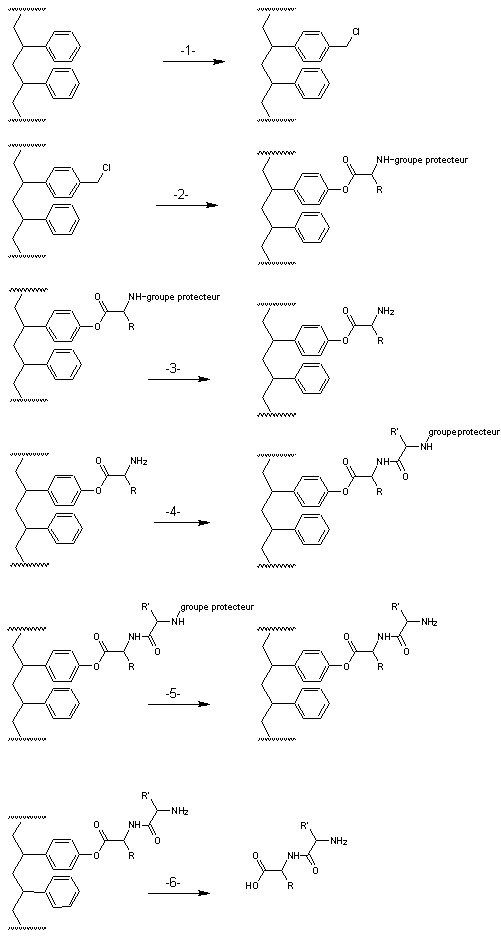
synthèse peptidique sur support solide est schématisé dans la figure ci-dessous
:
On
utilise un polymère sur lequel on greffe un groupement susceptible de réagir
avec l'extrémité carbonyle d'un amino-acide.
On
peut ainsi ancrer cet amino-acide sur une matrice solide.
A
partir du groupe amino libre de l'amino-acide ainsi fixé, on peut on peut fixer
un deuxième acide aminé par son extrémité carbonyle et obtenir un dipeptide que
l'on peut décrocher de la matrice.
Ainsi,
par exemple à partir du polystyrène :
 .
.
-1-
On greffe le groupe –CH2-Cl (chlorométhylation) par substitution
électrophile sur quelques noyaux benzéniques du polymère, groupe susceptible de
réagir avec le groupe carbonyle d'un amino-acide.
-2-
On fait réagir un amino-acide dont on a protégé la fonction amine sur la
matrice ainsi transformée.
![]()
-3-
On enlève la protection du groupe amino
![]()
-4-
On fait réagir un nouvel acide aminé dont on a protégé la fonction amine sur la
fonction amine libérée.
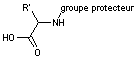
-5-
On enlève la protection du groupe amino
-6-
On détache le dipeptide ainsi formé de la matrice.
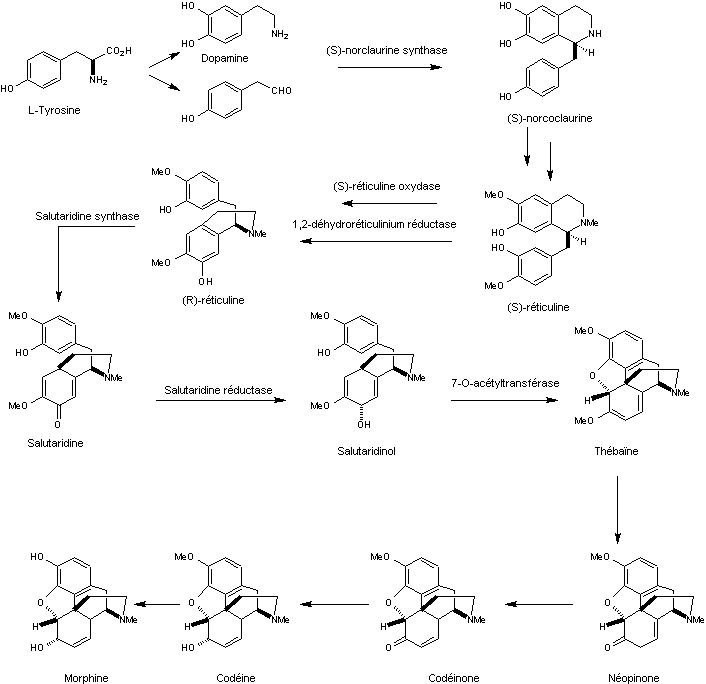
5-2) Biosynthèse
d'une molécule naturelle exogène pour bloquer les récepteurs de la douleur :
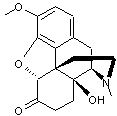
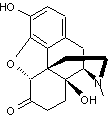
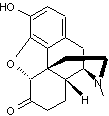
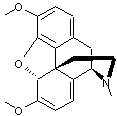
La morphine
L'opium
est utilisé en médecine depuis le IIIe millénaire av. J.-C. dans diverses
cultures et il a été l'un des piliers de la pharmacopée traditionnelle. La
morphine n'a été néanmoins découverte et isolée qu'en 1804 ; sa nature chimique
et son usage pharmaceutique ont été établis au cours des années suivantes par
l'Allemand Friedrich Wilhelm Sertürner, révolutionnant l'analgésie dans la
médecine. En 1925, Robinson propose une structure correcte de la morphine qui
sera confirmée en 1952 par Gates avec la première synthèse totale de ce composé
en 31 étapes avec un rendement global de 0.06 %*. La connaissance de la
structure tridimensionnelle de la morphine est essentielle pour établir le lien
entre sa structure et son activité biologique qui résulte de sa liaison avec un
récepteur spécifique. La structure des biomolécules et de leurs complexes est
le plus souvent obtenue en phase condensée par cristallographie X ou par
résonance magnétique nucléaire (RMN). En 1955, la structure de la morphine a
été obtenue par Hodgkin par cristallographie**.
L’étude
de la biosynthèse d’une molécule est importante car elle permet de caractériser
les intermédiaires clés et elle constitue une source d’inspiration considérable
pour les chimistes.
La
biosynthèse de la morphine a pu être élucidée grâce à l’isolement
d’intermédiaires présents dans le pavot, comme la L-Tyrosine***. Deux molécules
de tyrosine sont impliquées en amont de la synthèse. Elles subissent l’action
de deux enzymes différentes qui permettent d’obtenir d’une part la dopamine, et
d’autre part le p-hydroxyphénylacétaldéhyde. Les enzymes sont des protéines qui
catalysent des transformations en chimie organique, elles peuvent être chimio-,
régio-, et stéréosélectives d’une réaction de nature donnée.
*M Gates; G Tschudi, G., The synthesis of Morphine. J.
Am. Chem. Soc., (1952), 74, 1109-1110; (b) M, Gates; G, Tschudi. The synthesis
of morphine. J. Am. Chem. Soc., (1956), 78, 1380-1393.
**M. Mackay; DC, Hodgkin, A crystallographic
examination of the structure of morphine. J. Chem. Soc. (1955), 3261-3267
*** P. R Blakemore ; J. D. White. Morphine, the
Proteus of organic molecules. Chem. Comm. (2002), 1159-1168; (b) D. F Taber; T.
D Neubert.; M.F., Schlecht. Strategies and Tactics in Organic. Synthesis, (2004), 5,
353-389.
Biosynthèse
de la morphine