ESTERIFICATION-HYDROLYSE-SAPONIFICATION
1) Définition
2) Propriétés
4) Estérifications à partir de
chlorures d'acyles ou d'anhydrides d'acides
5) Hydrolyse
7) Mécanisme de l'estérification par catalyse
acide:
8) Résumé
1) Définition : Estérification.
C'est le chimiste et physiologiste allemand Leopold
Gmelin (1788-1853) qui forgea vers 1850 le terme Ester contraction de Essigäther ( der Essig : le vinaigre + der Äther : l'éther).
Un alcool réagit avec un acide carboxylique pour donner un ester,
selon la réaction :
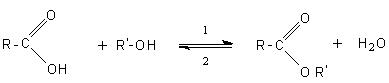
Cette réaction est catalysée par les acides forts (H2SO4).
La réaction est réversible et la réaction inverse (2) est l'hydrolyse.
2) Propriétés: Réaction lente,
limitée, athermique; la quantité d'ester formé, dépend de la classe de
l'alcool :
Si l'on part d'une mole d'alcool et d'une mole d'acide, on
obtient, avec un alcool:
- primaire ......... 0,67 mole d'ester
- secondaire...... 0,60 mole d'ester
- tertiaire............0,05 mole d'ester
On peut augmenter la vitesse des 2 réactions inverses, donc
atteindre plus rapidement l'état d'équilibre, en chauffant, ou en ajoutant un
catalyseur; mais cela n'a aucune influence sur les quantités d'ester obtenues.
On peut par contre déplacer l'état d'équilibre donc améliorer le
rendement, en utilisant un excés de l'un des réactifs
( en général, celui qui est le moins onéreux), ou
éliminer un des produits formés, au fur et à mesure de sa formation (souvent
l'eau, par différentes techniques: distillation...).
3) Coupures des liaisons: Le mécanisme n'est pas simple
et n'est pas le même dans tous les cas (voir ci-dessous avec un alcool
primaire); le marquage isotopique (utilisation de 18O au lieu de 16O pour l'alcool)
a permis de montrer que l'O de l'alcool se retrouvait (avec un alcool primaire)
dans l'ester et non dans l'eau d'où les coupures des liaisons suivantes:
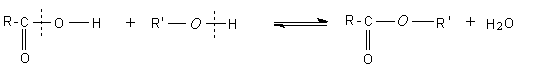
Cela n'est pas un mécanisme, mais une indication importante.
4) Formation des esters à partir de
chlorures d'acyles ou d'anhydrides d'acides:
Ces réactions sont plus rapides et totales;
- Avec un chlorure d'acyle:
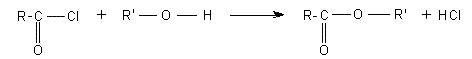
- Avec un anhydride
d'acide
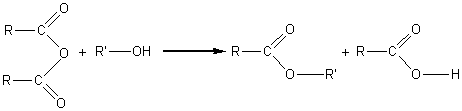
Bien que conduisant à un ester, il vaut mieux appeler ces
réactions acylations plutôt qu'estérifications, ce terme étant réservé à
l'action d'un acide sur un alcool.
Cette réaction conduit à un acide carboxylique et à un
alcool;

réaction réversible et limitée par la réaction inverse (estérification);on
peut la rendre plus complète et donc améliorer le rendement, en utilisant un
grand excès d'eau.
Il s'agit de la réaction d'un ester avec une base alcaline
(soude ou potasse):
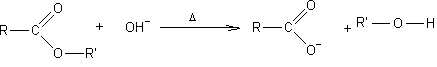
Elle fournit le sel de sodium (ou de potassium) de l'acide qui a
donné l'ester (dans le cas d'un corps gras il
s'agira du sel de sodium ou de potassium d'un acide gras, que l'on appelle un
savon) et un alcool (dans le cas d'un corps gras il s'agira du glycérol).
C'est une réaction non inversible. Elle sert à préparer les savons (d'où son nom).
Remarque :On appelle indice de saponification, la
masse (en mg) de KOH nécessaire pour saponifier 1g du corps gras.
7) Mécanisme de l'estérification (par un alcool
primaire) par catalyse acide:
Il s'agit d'une addition
nucléophile de l'alcool sur le carbone du groupement carboxyle de l'acide,
après que l'oxygène doublement lié au carbone de ce groupement carboxyle ait
été protoné.
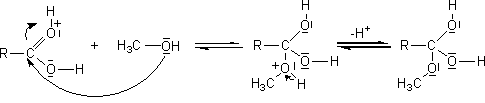
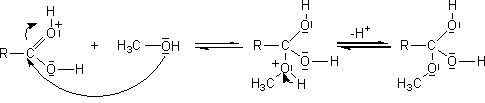
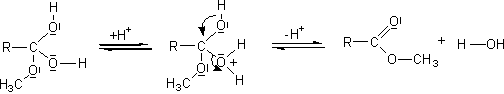
Ce mécanisme est en accord avec le fait mentionné plus haut:
l'oxygène de l'eau formée provient du OH de l'acide et non de l'alcool.
Remarque : Le mécanisme de l'hydrolyse en milieu acide,
est exactement celui de l'estérification mais en partant de la fin et en
remontant ; en effet toutes les étapes sont réversibles.