QUELQUES REACTIONS EN CHIMIE ORGANIQUE
Plan
du TP:
1) Alcanes:
2) Alcènes:
3) Aldéhydes et cétones:
4) Alcools:
5) Amines:
6) Acides carboxyliques:
- Les alcanes sont des hydrocarbures saturés à chaînes ouvertes.
- Les alcanes sont en général stables et peu réactifs. Il n'est pas envisagé de réactions avec modification de la chaîne carbonée; On s'intéressera seulement à la cassure de liaisons C-H et au remplacement de l'hydrogène par un autre élément. Il s'agit alors d'une réaction de substitution.
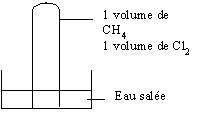
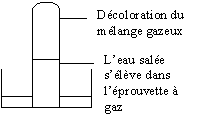
Initialement les deux éprouvettes sont entourées d'un cache noir.
Une des deux éprouvettes est exposée à la lumière ; on constate dans ce cas une
modification du milieu.
- Les alcènes sont des hydrocarbures acycliques possédant une double liaisonC=C .
- La présence de la double liaison dans la chaîne carbonée donne aux alcènes un site très réactif. Par ouverture de cette double liaison (p ) les alcènes donnent des réactions d'addition.

On observe la décoloration de la solution de dibrome ; cette décoloration s'explique par la réaction d'addition du dibrome sur l'alcène). ATTENTION! La manipulation du tétrachlorométhane doit se faire sous une hotte aspirante ( produit très toxique).
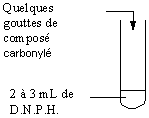
3-1) Réaction caractéristique commune aux aldéhydes et aux cétones : test à la D.N.P.H.
D.N.P.H. : 2,4 dinitro
phénylhydrazine.
Aldéhydes : HRC=O
Cétones : RR’C=O

3-2) Caractère réducteur des aldéhydes.
Rappel : A quelques mL de réactif de Schiff glacé, on ajoute quelques gouttes d'éthanal : le
réactif vire au rose fuschia. Ce test est valable
pour tous les aldéhydes ; il permet de les distinguer des cétones qui ne font
généralement pas virer le réactif de Schiff.
Malheureusement, ce test n'est pas toujours fiable, car le virage au rose peut
être observé avec d'autres types de composés aromatiques que les aldéhydes, ou
par simple chauffage ; aussi lui préfère-t-on bien souvent l'un des tests
suivants, basés sur le caractère réducteur des aldéhydes.
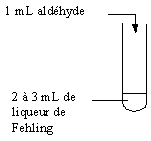
- Réduction de la liqueur de Fehling.
Dans
quelques mL de solution de sulfate de cuivre(II) on
verse progressivement une solution basique contenant des ions tartrate -OOC-CHOH-CHOH-COO-
; il se forme tout d'abord un précipité bleu clair d'hydroxyde de cuivre(II)
Cu(OH)2
qui se dissout ensuite dans un excès de solution de tartrate, en donnant une
solution limpide dont la couleur bleu roi est due à l'ion complexe que nous
noterons Cu2+complexé . Cette solution est appelée
liqueur de Fehling.

- Réduction du nitrate d'argent ammoniacal: formation du miroir d'argent.
Dans
quelques mL de solution de nitrate d'argent on ajoute
progressivement une solution d'ammoniac ; il se forme tout d'abord un précipité
brun d'oxyde d’argent Ag2O qui se dissout ensuite dans
un très léger excès de solution d'ammoniac, en donnant l'ion complexe incolore
Ag(NH3)2+ ,ion diammine
argent(I). Cette solution est appelée nitrate d'argent ammoniacal ou réactif
de Tollens.
3-3) Réaction caractéristique des cétones méthylées : réaction haloforme.
Les cétones méthylées ou méthylcétones ont pour formule semi-développée CH3COR.
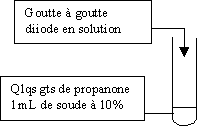
Il
se forme un précipité jaune de CHI3 . Avec le diiode
le test porte le nom de test à l' iodoforme.
4-1) Oxydation catalytique de l'éthanol par le dioxygène de l'air.
Expérience de la lampe sans flamme
:
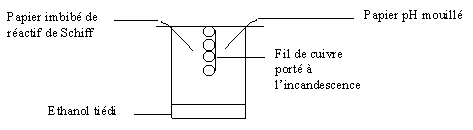
Le fil de cuivre rougi reste rouge
dans les vapeurs d’éthanol.
Le papier imbibé de réactif de Schiff rosit.
Le papier pH mouillé rougit.
4-2) Les trois classes d'alcools.Oxydation ménagée des alcools.
Test
de Lucas: Test analytique des trois classes d'alcools .
Dans un tube à essai, mettre 20 gouttes de l'alcool à tester et une solution de
chlorure de zinc dans l'acide chlorhydrique. A température ordinaire on passe
de R-OH à R-Cl; pour les alcools tertiaires la réaction est pratiquement
immédiate (le chlorure d'alkyle formé insoluble trouble la solution); pour les
alcools secondaires il faut attendre une dizaine de minutes pour voir
apparaître le trouble; pour les alcools primaires la réaction est très lente.
Oxydation ménagée : oxydation sans destruction de la chaîne carbonée.
Alcool primaire classe I
R-CH2-OH
Butan 1-ol CH3CH2CH2CH2OH
Alcool secondaire
classe II ![]() Butan 2-ol CH3CH2CHOHCH3
Butan 2-ol CH3CH2CHOHCH3
Alcool tertiaire
classe III ![]() 2-méthylbutan-2-ol CH3CH2C(CH3)OHCH3
2-méthylbutan-2-ol CH3CH2C(CH3)OHCH3
|
Alcool classe |
Oxydation ménagée - Oxydant
en défaut |
Oxydation ménagée –
Oxydant en excès |
|
I |
Aldéhyde |
Acide carboxylique |
|
II |
Cétone |
Cétone |
|
III |
Pas d’oxydation |
Pas d’oxydation |
Mise en évidence expérimentale
: On utilise une solution saturée de dichromate de potassium K2Cr2O7 en milieu acide sulfurique. [K2Cr2O7] = 0,3mol.L-1.
Attention : L'addition de la solution de dichromate doit être
réalisée avec une grande prudence. Verser la solution très lentement,
goutte à goutte.
S’il y a oxydation des alcools Cr2O72-
jaune orangé devient Cr3+
vert.
.Oxydant en défaut :

Dans les tubes I et II la teinte orangée des ions dichromate a disparu. Les
mélanges sont bleu vert coloration due aux ions Cr3+.
Dans le tube III la teinte orangée des ions dichromate persiste : il ne s'est
apparemment rien produit.
Mise en évidence des produits obtenus:
Extraction des parties organiques par
un solvant : l'hexane (3mL).
Séparation de la phase organique et division de cette phase en deux parties. I
donne I’ et I’’. II donne II’ et II’’.
I’ et II’ sont testés par le réactif de Schiff.
I’ donne une coloration rose violet. II’ ne donne rien.
I ’’ et II’’ sont testés par la D.N.P.H. dans les deux cas
on observe un précipité jaune.
Oxydant en excès :
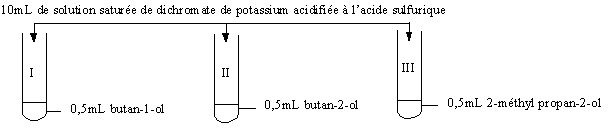
Dans les tubes I et II la teinte orangée des ions dichromate a disparu. Les
mélanges sont bleu vert coloration due aux ions Cr3+.
Dans le tube III la teinte orangée des ions dichromate persiste : il ne s'est
apparemment rien produit.
Mise en évidence des produits obtenus :
Extraction des parties organiques par
un solvant : l'hexane (3mL).
Séparation de la phase organique et division de cette phase en deux parties. I
donne I’ et I’’. II donne II’ et II’’.
I’ et II’ sont testés par le réactif de Schiff.
I’ et II’ ne donnent rien.
I ’’ et II’’ sont testés par la D.N.P.H. I’’ ne
donne rien, II’’ donne un précipité jaune.
Récapitulatif :
|
|
Oxydant en défaut |
Oxydant en défaut |
Oxydant en excès |
Oxydant en excès |
|
Réactifs et tubes |
I |
II |
I |
II |
|
Schiff |
rose violet |
Rien |
rien |
rien |
|
D.N.P.H. |
précipité jaune |
précipité jaune |
rien |
précipité jaune |
|
Conclusions |
Butan-1-al |
Butanone |
Acide butanoïque |
Butanone |
5-1) Propriétés basiques des amines.
La présence d'un doublet
d'électrons non liant sur l'atome d'azote permet aux molécules d'amines de
capter un proton H+. Si par convention nous écrivons le couple
acide/base conjuguée : acide = base conjuguée + H+, cela revient à
écrire pour une amine primaire : R-NH3+
= R-NH2 + H+.
Les amines possèdent un atome d'azote lié à un, deux ou trois atomes de carbone
par des liaisons covalentes simples. Nous distinguerons les amines aliphatiques
(le ou les groupements R sont des groupements alkyles) des amines aromatiques
(le ou les groupements R sont des groupements dont l'un au moins est un
groupement carboné aromatique). Les exemples choisis seront les suivants :
|
Type
d'amines |
Formule générale |
Acide
et base conjugués |
Nom de la base |
Ka
à 25°C et pKa |
|
|
|
NH4+/NH3 |
ammoniac |
5,5.10-10 9,3 |
|
Amine
primaire |
R-NH2 |
CH3CH2NH3+/CH3CH2NH2 |
éthylamine |
1,6.10-11 10,8 |
|
Amine
secondaire |
R-NH-R' |
(CH3CH2)2NH2+/(CH3CH2)2NH |
diéthylamine |
7,9.10-12 11,1 |
|
Amine
tertiaire |
R-N-R'R'' |
(CH3CH2)3NH+/(CH3CH2)3N |
triéthylamine |
2,5.10-11 10,6 |
|
Amine
aromatique |
Ar-NH2 |
C6H5-NH3+/ C6H5-NH2 |
aniline |
2,3.10-5 4,6 |
5-1-1) Comparaison de la basicité de l'ammoniac et des amines.
Mesure du pH des solutions proposées en exemples.
|
Solutions |
pH |
|
ammoniac |
|
|
Ethylamine |
|
|
Diéthylamine |
|
|
Triéthylamine |
|
|
aniline |
|
Conclusion : Les amines sont des bases plus fortes que l'ammoniac, mais restent des bases faibles.
La basicité dépend de la classe de l'amine, elle augmente avec la classe de l'amine. On note toutefois une anomalie : l'amine tertiaire a un caractère basique moins marqué car l'effet de solvatation en milieu aqueux joue en sens inverse de l'effet électronique.
L'amine aromatique a un caractère basique plus faible que l'ammoniac.
5-1-2) Action sur le chlorure d'hydrogène.
Tremper : un agitateur de verre dans une solution d'acide chlorhydrique concentrée,
un autre agitateur dans une solution éthylamine concentrée,
Rapprocher ces deux agitateurs. Des fumées blanches de chlorure d'éthylammonium se forment.
5-1-3) Action sur les ions métalliques.
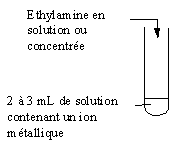
|
Ion métallique |
Observation |
|
Cu2+ |
|
|
Fe2+ |
|
|
Fe3+ |
|
|
Al3+ |
|
5-2) Caractère nucléophile des amines.
Le doublet d'électrons non liant de l'atome d'azote d'une amine peut s'unir à un atome de carbone d'une autre molécule organique (dérivé halogéné, alcool, acide carboxylique, chlorure d'acyle, anhydride d'acide) c'est la réaction d'un centre négatif (la paire d'électrons) sur un centre positif. Ce centre "donneur d'électrons" est appelé centre nucléophile.
6) Les acides carboxyliques R-COOH.
C'est la présence du groupement -COOH dans une molécule organique qui lui confère ses propriétés acides.
Nous étudierons l'acide éthanoïque CH3COOH qui est un acide faible. CH3COOH/CH3COO- pKa=4,75.
Les comparaisons seront établies avec le chlorure d'hydrogène HCl qui est un acide fort.
6-1)Caractère acide faible de l'acide éthanoïque.
6-1-1) Dissociation de l'acide éthanoïque en solution aqueuse.
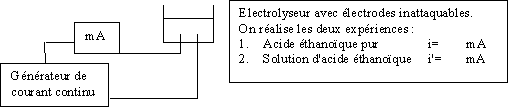
6-1-2) Mesure du pH de solutions acides.
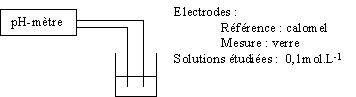
|
Solutions |
pH |
|
Acide chlorhydrique |
|
|
Acide éthanoïque |
|
Conclusion : Le pH de la solution d'acide éthanoïque est plus élevé que celui d'une solution d'acide chlorhydrique de même concentration, donc l'acide éthanoïque contient moins d'ions hydronium (H3O+) libres que l'acide chlorhydrique qui est un acide fort totalement dissocié en solution aqueuse.
La dissociation ionique de l'acide faible n'est que partielle en solution aqueuse.
6-2) Action sur les métaux.
