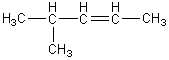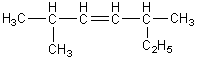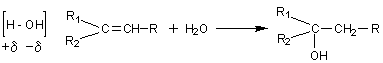LES ALCENES
1) Définition - Formule générale :
2) Nomenclature
3) La liaison éthylénique - Isomérie Z-E
4) Propriétés physiques
5) Géométrie
des molécules
6) Propriétés chimiques
7) Préparations
8) Résumé
1) Définition - Formule
générale :
Ce
sont des hydrocarbures (substances formées uniquement de carbone et
d'hydrogène) acycliques (chaîne carbonée ouverte), possédant une double liaison
carbone-carbone (C=C).
Leur
formule générale est CnH2n.
Ils
sont rares à l'état naturel.
2) Nomenclature
:
Mêmes
règles que pour les alcanes ; on remplace "ane" par "ène".
La
chaîne principale est donc désignée par un préfixe indiquant son nombre de
carbones, puis, placé entre deux tirets, le numéro (le plus petit possible) du
1er carbone de la liaison double et on termine par la désinence
"ène" ; On met en préfixe les groupes ne faisant pas partie de la
chaîne principale précédés du numéro du carbone qui les porte. La chaîne
principale doit contenir la double liaison.
Exemples :
|
CH3-CH=CH-CH2-CH3 |
|
|
|
|
|
pent-2-ène |
3-méthylbut-1-ène |
4-méthylpent-2-ène |
2,5-diméthylhept-3-ène |
3,6-diméthyloct-4-ène |
|
Formule moléculaire : |
Formule moléculaire : |
Formule moléculaire : |
Formule moléculaire : |
Formule moléculaire : |
Remarque 1 : Une molécule
ayant plusieurs liaisons doubles, n'est pas un alcène. La nomenclature est
cependant la même en ajoutant le préfixe indiquant le nombre de doubles
liaisons (di, tri ...) devant "ène" .
Exemples :
CH2=CH-CH=CH2
buta-1,3-diène (le "a" ajouté au préfixe indiquant le nombre de
carbones évite le "hiatus" entre deux consonnes).
CH2=CH-CH=CH-CH=CH2
hexa-1,3,5-triène.
Remarque
2 : Le premier terme CH2=CH2 est l'éthène
appelé aussi éthylène.
3) Géométrie
des molécules d'alcènes - L'isomérie Z-E :
3-1) Géométrie de l'éthène
:
La
molécule d'éthène est plane, la double liaison C=C empêchant la libre rotation
autour de l'axe des carbones. Les angles entre les liaisons sont de 120° autour
des carbones.La distance C=C est 0,134 nm, c'est-à-dire plus courte que la
distance C-C des alcanes (0,154 nm).
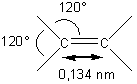
3-2) Géométrie des autres
alcènes :
Autour
de la double liaison la molécule est plane, les angles sont de 120° et la
distance C=C de 0,134 nm.
3-3) Les isoméries :
On
distingue trois types d'isomérie qu'on va illustrer en prenant comme exemple
les molécules ayant comme formule moléculaire C5H10.
- l'isomérie de chaîne :
Ils
diffèrent par la structure de la chaîne des carbones :
![]()
pent-1-ène
3-méthyl-but-1-ène
- l'isomérie
de position de la double liaison :
Pour
une chaîne donnée (par exemple celle du pent-1-ène) il peut y avoir plusieurs
positions de la double liaison :
![]()
pent-1-ène
![]()
pent-2-ène
- l'isomérie Z-E (ou cis-trans) :
C'est
l'empêchement de la libre rotation autour des carbones de la double liaison qui
fait apparaître ce type d'isomérie qui n'existait pas avec les alcanes :
Examinons
deux cas :
* 1er cas : Il existe un hydrogène et un seul fixé sur chaque
carbone de la double liaison, comme par exemple dans le but-2-ène :
On
a l'isomère Z (ou cis) si les deux hydrogènes placés sur les carbones
doublement liés sont du même côté de la double liaison :
Z-But-2-ène
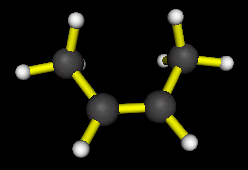
On
a l'isomère E (ou trans) si les deux hydrogènes placés sur les carbones
doublement liés sont de part et d'autre de la double liaison :
E-But-2-ène
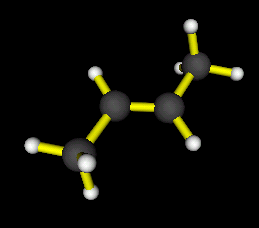
*
2ème cas : C'est le cas général, des substituants différents sont placés sur
les carbones de la double liaison ; on numérote alors les deux atomes
directement liés aux carbones de la double liaison selon la notation de Cahn-Ingold-Prelog et on regarde
comment sont placés les deux numéros 1:
Z :
Ils sont du même côté de la double liaison.
E :
lls sont de part et d'autre de la double liaison (opposés).
Exemple :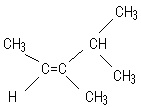
Le
carbone de gauche de la double liaison porte un H et un CH3. D'aprés
la règle de C.I.P. le C du groupement méthyle a le numéro 1 et le H le numéro 2.
Le
carbone de droite de la double liaison porte un méthyle et un groupement
isopropyle. Le C du groupement isopropyle a le numéro 1 et le C du groupement
méthyle le numéro 2.
Par
rapport à l'axe horizontal de la double liaison, les numéros 1 sont du même
côté, le composé sera Z ; il s'agit du (Z)-3,4-diméthylpent-2-ène.
4) Propriétés
physiques :
* C1
à C5 gazeux
* C6
à C18 liquides
* C19
---> solides.
Ils
sont insolubles dans l'eau.
5) Propriétés
chimiques :
La
double liaison n'est pas faite de deux liaisons identiques ; une liaison dite s est
identique à celle qui existe dans les alcanes entre les carbones, et l'autre,
dite liaison p, est moins forte.
Les
alcènes ont une grande réactivité ; la liaison p est un lieu d'attaque électrophile.Les
alcènes donnent surtout des réactions d'addition électrophiles.
5-1) Additions:
- a) H2(le dihydrogène) :
CnH2n + H2![]() CnH2n+2 (alcanes) .
CnH2n+2 (alcanes) .
Elle
peut avoir lieu en phase gazeuse sous pression avec du nickel (Ni) comme
catalyseur (C'est la réduction de Sabatier
et Senderens), ou en phase liquide avec du nickel Raney
(que l'on obtient en traitant par de la soude un alliage Aluminium-Nickel). En
phase liquide on peut aussi utiliser du platine Adams (oxyde de Pt), du platine
Vavon (réduction d'un sel de Pt par du formol), ou un métal comme le palladium,
ou le ruthénium ou enfin le chromite de cuivre (méthode d'Adkins).
* Ethène :
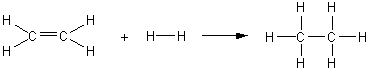
On
passe ainsi d'un alcène (ici l'éthène), composé insaturé, à un alcane
(ici l'éthane), composé saturé.
* Cas général :
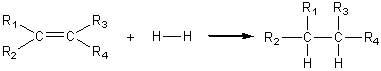
Remarque: Un alcène est rarement réduit en alcane ; on utilise par contre cette hydrogénation des doubles liaisons, pour saturer partiellement les huiles végétales (liquides) et les transformer en margarine (solide).
- b) X2 (halogénation) :
CnH2n + X2![]() CnH2nX2( dihalogéno-alcane).
CnH2nX2( dihalogéno-alcane).
* Ethène :
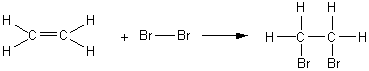
Le
composé obtenu est le 1,2-dibromoéthane.
Cette
réaction est à la base d'un test permettant de savoir si une substance possède
ou non des doubles liaisons :
On verse
quelques gouttes d'une solution de dibrome dans CCl4 (solution
rouge) dans un tube à essai contenant un peu du corps à analyser ; s'il y a
décoloration instantanée à froid c'est que la substance contient au moins une
double liaison carbone-carbone.
* Cas général :
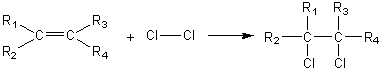
Remarque :
Le
diiode I2 ne s'additionne pas directement ; il faut faire agir ICl
ou IBr. C'est ainsi que l'on opère pour déterminer l'indice
d'iode des substances éthyléniques (corps gras en particulier). L'indice d'iode d'un
corps est le nombre de grammes de I2 que 100g
de ce corps peuvent fixer.
L'indice
d'iode est un indicateur de l'insaturation carbone-carbone d'une molécule
(notamment d'un corps gras).
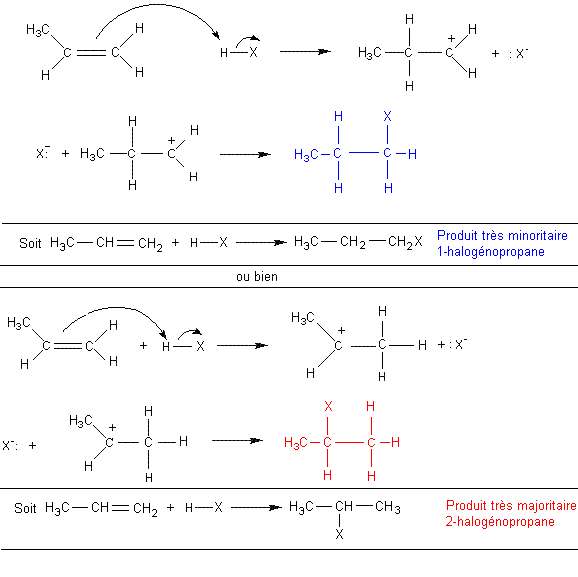
- c) HX (un halogénure d'hydrogène) :
Avec HBr et HI l'addition a lieu à basse température ; avec HCl il
faut chauffer (170°C) opérer sous pression et avec un catalyseur (ZnCl2).
alcène symétrique
R-CH=CH-R + HX![]() R-CH2-CHX-R
R-CH2-CHX-R
On
obtient un halogénoalcane.
Exemple :
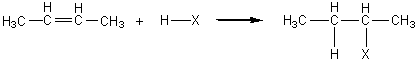
alcène dissymétrique
Deux
possibilités d'addition s'offrent.
Le
mécanisme de l'attaque électrophile montre qu'il y a dans un premier temps
formation d'un carbocation. Le carbocation secondaire est plus stable que le
primaire et conduit à un composé d'addition majoritaire. C'est ce que résume la
règle de Markovnikov.
Règle de MARKOVNIKOV: (régiosélectivité) l'hydrogène, lors d'une addition, se fixe sur le carbone le plus hydrogéné (le moins substitué).
Remarque : Les
alcènes peuvent également donner, dans d'autres conditions opératoires des
additions radicalaires qui se font avec orientation anti-markovnikov (C'est l'effet Karasch)
*En présence d'hydrogène (150°C, 200 bars cobalt-carbonyle comme
catalyseur) on obtient un aldéhyde:
R-CH=CH2
+CO + H2 ![]() R-CH2-CH2-CHO
ou
R-CH2-CH2-CHO
ou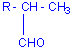 réaction d'Adkins
réaction d'Adkins
*En
présence d'eau (250°C, 200 bars nickel-carbonyle comme catalyseur) on obtient
un acide carboxylique:
R-CH=CH2
+CO + H2O ![]()
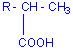
réaction
de Reppe.
5-2) Oxydations :
Remarque : Les époxydes sont aussi appelés
les oxiranes :
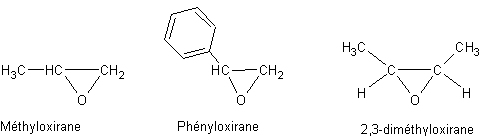
L’oxydation douce (par l'acide perbenzoïque par exemple) conduit
aux époxydes
![]()
qui
par hydratation conduisent aux a diols :
· b) Par l'ozone : (ozonolyse) on obtient un ozonure instable et par action de l'eau 2 aldéhydes (ou un aldéhyde et une cétone ou 2 cétones ou CO2 et un aldéhyde ou CO2 et une cétone) et de l'eau oxygénée.
exemple :
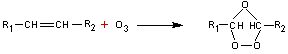
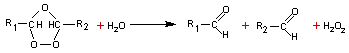
Un
aldéhyde se forme lorsque le carbone correspondant de la double liaison porte
un hydrogène. Dans le cas contraire on obtient une cétone. Si un des carbones
de la double liaison porte deux hydrogènes, c'est du dioxyde de carbone qui se
forme.
Remarque : En
général, si un aldéhyde est obtenu, il va être aussitôt oxydé en acide
carboxylique par l'action de l'eau oxygénée formée. Si l'on veut éviter cette
oxydation, il faut opérer en présence de zinc.
5-3) Résumé des propriétés chimiques
- Déshydratation des alcools :
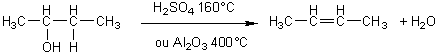
Le
groupe OH- s'élimine avec l'hydrogène porté par le carbone voisin le moins
hydrogéné ; cela constitue la règle de Zaïtsev.
Il
s'agit d'une réaction d'élimination. L'alcène obtenu a le même nombre de
carbones que l'alcool de départ.
- Déshydrohalogénation des dérivés monohalogénés :
- Craquage de fractions pétrolifères :
![]()
L'opération
conduit à des mélanges d'alcanes et d'alcènes qu'on sépare ensuite par
distillation fractionnée.