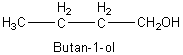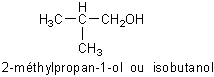ALCOOLS
- Formule générale
- Les
3 classes d'alcools
- Nomenclature
- Quelques
alcools
- Propriétés physiques
- Différenciation des 3 classes d'alcools
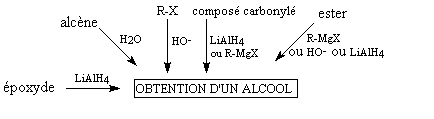
- Réactions importantes
- Préparations
- Résumé
Formule générale R-OH
-OH est le
groupe hydroxyle
Remarques: -Un alcool est un composé organique dans
lequel un groupe hydroxyle est fixé sur un atome de carbone
tétragonal
-Un
alcool à chaîne carbonée saturée a pour formule générale CnH2n+1OH
Les trois classes d'alcools:
Alcools primaires
R-CH2-OH
Alcools I
Alcools
secondaires
![]() Alcools II
Alcools II
Alcools
tertiaires
![]() Alcools
III
Alcools
III
Nomenclature :
Le nom est formé d'un préfixe décrivant la chaîne carbonée suivi de l'indice de position du groupe hydroxyle plus la terminaison ol
Quelques alcools:
|
Nom |
Formules |
Classe |
|
méthanol |
CH3OH |
Alcool primaire |
|
éthanol |
CH3-CH2-OH |
Alcool primaire |
|
propan-1-ol |
|
Alcool primaire |
|
propan-2-ol |
|
Alcool secondaire |
|
Butan-1-ol |
|
Alcool primaire |
|
2-méthylpropan-1-ol |
|
Alcool primaire |
|
2-méthylpropan-2-ol |
|
Alcool tertiaire |
|
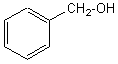
phényl méthanol |
|
Alcool primaire |
|
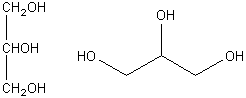
polyalcool:
|
|
|
|
polyalcool: |
|
|
|
alcool insaturé: |
CH2=CH-CH2-OH |
Alcool primaire |
|
alcool à chaîne cyclique: |
|
Alcool secondaire |
remarques:
CH3-CH=CH-OH
n'est pas un alcool mais un énol
Ar-OH
n'est pas un alcool mais un phénol
Propriétés physiques:
-
Aucun alcool n'est gazeux à la température ordinaire.
-
Les alcools primaires de la série aliphatique normale sont liquides jusqu'en
C12.
-
Les alcools sont nettement moins volatils que les alcanes correspondants.
Exemples:
température d'ébullition sous 760mm de Hg:
méthane: -161,5°C
méthanol: +64,7°C
éthane: -88,5°C
éthanol: +78,3°C
propane: -42,2°C
propan-1-ol: +97,2°C
-
Les alcools sont nettement plus solubles dans l'eau que les alcanes
correspondants.
Ces
deux dernières propriétés sont liées au caractère polaire de la liaison O-H
du groupement hydroxyle.(formation de liaisons hydrogène)
-
Ce sont de bons solvants aussi bien de substances non organiques (diiode, bases
alcalines) que de substances organiques (huiles essentielles, résines,
camphre....).
Différenciation des trois classes d'alcools:
Par
oxydation ménagée (sans destruction du squelette carboné de la molécule oxydée)
en présence des ions permanganate ou dichromate en milieu acide.
-si l'oxydant est en défaut:
un alcool primaire donne un aldéhydeRCHO
(R-CH2OH ![]() R-CHO + 2H+ + 2e-) x3
R-CHO + 2H+ + 2e-) x3
![]()
Le
bilan:
Cr2O72-
+ 3 R-CH2OH + 8H+![]() 3 R-CHO + 2Cr3+ + 4H2O
3 R-CHO + 2Cr3+ + 4H2O
un alcool secondaire donne une cétone
![]()
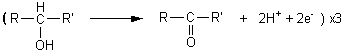
![]()
Le
bilan:
un alcool tertiaire n'est pas oxydé
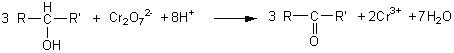
-si l'oxydant est en excès:
un alcool primaire donne un acide carboxylique R-COOH
(R-CH2OH + H2O![]() R-COOH + 4H+ + 4e-) x3
R-COOH + 4H+ + 4e-) x3
(![]() )x2
)x2
Le
bilan:
2
Cr2O72- + 3 R-CH2OH + 16H+![]() 3 R-COOH + 4Cr3+ + 11H2O
3 R-COOH + 4Cr3+ + 11H2O
un alcool secondaire donne une cétone RCOR'
un alcool tertiaire n'est pas oxydé .
Un alcool réagit avec un acide carboxylique pour donner un ester et de l'eau, selon la réaction :
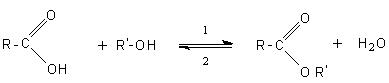
Cette réaction est catalysée par les acides forts (H2SO4). La réaction est renversable et la réaction inverse (2) est l'hydrolyse.
Réaction lente,limitée,renversable et athermique.
Déshydratation:
-intramoléculaire:
alcool![]() alcène + eau
alcène + eau
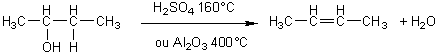
C'est
le carbone le moins hydrogéné qui cède son hydrogène (règle de Zaïtsev)
-intermoléculaire:
alcool + alcool![]() éther-oxyde + eau
éther-oxyde + eau
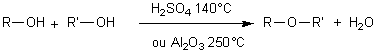
Déshydrogénation:
alcool I ![]() aldéhyde
+ dihydrogène
aldéhyde
+ dihydrogène
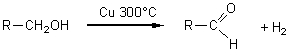
alcool
II ![]() cétone
+ dihydrogène
cétone
+ dihydrogène
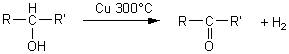
Action d'un composé carbonylé: acétalisation
![]()
blocage
de la fonction carbonylée par formation d'un acétal; on peut ensuite régénérer
le
groupement
C=O par action de l'eau.
Résumé des
principales réactions :
Fiches de TP :
-Recherche de la classe d'un alcool par oxydation
ménagée
-Réaction d'estérification : ThéorieTP
Exercices:
-Exercice 12:
Détermination de la formule brute d'un composé organique oxygéné.