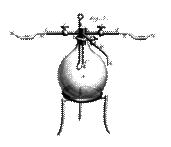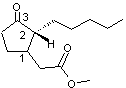SYNTHESES
Définitions
Gérard GOMEZ
avec la collaboration de
Jacques BARON
Plan de l'étude :
1) Qu'est-ce qu'une synthèse ?
1-1) Etymologie
1-2) Dans le
langage académique
1-3) Dans le
langage courant du chimiste
1-4) Dans le
langage des chercheurs
2) Synthèses totales
et synthèses partielles
2-1)
Dans l'histoire
2-2)
De nos jours
3) Synthèses
stéréosélectives – synthèses stéréospécifiques
3-1)
Synthèses stéréosélectives
3-2)
Synthèses stéréospécifiques
Synthèse totale de la cortisone par
Woodward
Synthèse partielle de la cortisone à
partir de la diosgénine
Mécanisme de la substitution SN2
Mécanisme de l'action du dibrome
dans CCl4 sur le (Z)-but-2-ène
Mécanisme de l'action d'une base
forte sur le 3-bromo-3,4-diméthylhexane
Stéréo-isomérie du dihydrojasmonate
de méthyle
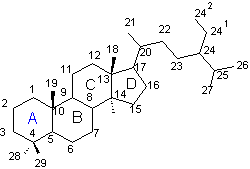
Numéros des sommets dans les
stéroïdes
1) Qu'est-ce qu'une synthèse ?
1-1) Etymologie
Σύνθεσις,
synthèse, composition, de σὺν, avec, et
θέσις, action de poser (Littré).
L'idée
générale du mot est "mettre ensemble", "réunir".
1-2) Dans le langage
académique :
On
trouve sur le dictionnaire de l'Académie française la définition suivante du
mot "synthèse" :
"En termes de Chimie, il désigne l'Action de composer un
corps avec ses éléments. On peut obtenir l'acétylène par synthèse.
Parfum de synthèse."
Le
terme "élément" a des acceptions différentes dans les deux exemples
donnés :
- On
peut obtenir l'acétylène par synthèse : ici on compose une molécule à
partir de ses deux éléments constitutifs Carbone et Hydrogène. Le mot élément
est pris dans son sens chimique.
|
|
Le
dispositif ci-contre correspond à "l'œuf de Berthelot". Dans
une enceinte ovoïde en verre, vide d'air, Berthelot fait circuler un courant
d'hydrogène et provoque un arc électrique entre deux électrodes en carbone (graphite).
Il se forme de l'acétylène par réaction de l'hydrogène sur le carbone des
électrodes portées à blanc, suivant l'équation :
On
met en évidence l'acétylène en faisant barboter le gaz obtenu dans un verre à
pied contenant un sel de cuivre (I) en milieu ammoniacal,dissout dans l'eau.
On voit le contenu du verre à pied devenir rouge, la couleur de l'acétylure
de cuivre (I) :
Remarque
1
: pour éviter que l'acétylène ne se décompose en refroidissant, il faut le
"tremper" c'est-à-dire le refroidir brutalement dès sa formation. Remarque
2
: cette synthèse a contribué à renforcer la démonstration que Wöhler avait
faite en 1928 en synthétisant l'urée : contrairement à ce qui est admis à
l'époque, aucune "force vitale" n'est nécessaire pour fabriquer un
produit organique à partir de substances réputées minérales. |
- Parfum
de synthèse : On obtient un parfum en mélangeant des extraits naturels avec
des entités odorantes fabriquées chimiquement. On oppose dans cette définition Parfum
de synthèse et Parfum naturel c'est-à-dire obtenu en
mélangeant uniquement des extraits de substances naturelles ; le mot élément a
ici un sens plus général : partie d'un tout.
La
synthèse consiste dans les deux cas à réaliser des mélanges.
|
|
Le
parfumeur est tout à fait comparable à un compositeur de musique ; devant son
orgue à parfums, multitude de petits flacons enveloppant les senteurs de
base, il joue avec les notes, les rapproche, les unit, les renforce ou les
assouplit au gré de sa sensibilité, pour atteindre un ensemble qui évoluant
en trois temps (tête, cœur, fond) dévoile peu à peu des trésors olfactifs. Le
chimiste n'est pas loin ; sans cesse il tente de repérer dans les fleurs, les
fruits, les feuilles, les écorces, les racines, pour ne parler que des
végétaux, des principes qu'il extrait par différentes techniques, à chaud, à
froid, avec de l'eau ou des solvants et qui viendront enrichir la palette des
senteurs nouvelles. Il synthétise aussi un grand nombre de molécules ; cinq
pour cent seulement des senteurs des parfums sont dues de nos jours à des
molécules extraites de produits naturels. |
1-3) Dans le
langage courant du chimiste :
- Historiquement
:
Faire
une synthèse, aux débuts de la chimie organique moderne, c'est reproduire à
l'identique des substances naturelles.
Ainsi à
la fin du XIXème siècle et au début du XXème a-t-on assisté à une très grande
activité de synthèse des alcaloïdes au fur et à mesure de leur découverte et de
la mise en évidence de leurs vertus thérapeutiques ; on en citera quelques-unes
:
|
|
La
cocaïne Alcaloïde extrait des feuilles de coca ; anesthésique local
et stimulant du système nerveux central. Son usage prolongé conduit à une
grave toxicomanie. |
|
|
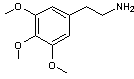
La
L-Nicotine Un alcaloïde présent dans les feuilles de tabac (2 à 8
% dans les feuilles séchées), a été découverte en 1809 par Louis-Nicolas Vauquelin ;
elle a été isolée pour la première fois par les chimistes allemands Posselt
et Reimann ; sa structure a été élucidée par Pinner et Wolffenstein en 1895 ;
Aimé Pictet (Professeur à Genève) joua un rôle décisif dans sa synthèse en
1903. |
|
|
L'α-Narcotine Un alcaloïde de l'opium,
extrait du latex du pavot à
opium, tout comme la morphine,
la codéine, la papavérine ; elle a été
découverte en 1817 par Robiquet ; sa synthèse a été menée à bien par W.H.Perkin junior en 1911. |
|
|
La
Mescaline Un alcaloïde non hétérocyclique
; c'est une substance hallucinogène produite en particulier par le peyotl (Echinocactus williamsii ), cactacée du
Mexique et du sud-ouest des Etats-Unis ; c’est le chimiste allemand Ernst Späth qui en réalisa le
premier la synthèse en 1919. |
La
nécessité d'effectuer des synthèses de produits existant naturellement
s'imposait lorsque l'extraction de ce composé s'avérait difficile, laborieuse
ou lorsque la matière première d'où on l'extrayait existait en quantité insuffisante eu égard aux besoins ; on y
avait recours également lorsque les coûts de l'extraction étaient très élevés.
Peu à
peu les chimistes ont étendu ce terme aux substances dérivées de ces produits
naturels par légères modifications de ceux-ci ; la molécule ainsi obtenue se
montrait parfois plus efficace que le produit naturel.
- De nos jours
Le
champ d'utilisation du mot synthèse s'est beaucoup élargi.
Effectuer
une synthèse c'est obtenir une espèce chimique à partir d'autres espèces, par
réaction.
C'est
une définition très générale mais qui exclut par exemple les mélanges.
Dans ce
contexte une synthèse peut se dérouler en une ou plusieurs étapes, concerner
les opérations effectuées en laboratoire ou dans l'industrie (on parle alors de
synthèse industrielle) et concerne également des opérations qui font appel à
certaines substances habituellement présentes dans les milieux biologiques
(enzymes par exemple).
On
illustrera cette définition en décrivant deux synthèses, l'une industrielle,
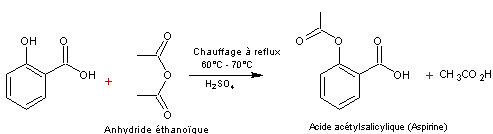
l'autre en laboratoire, d'un médicament qui traverse les siècles, l'aspirine.
- Synthèse industrielle :
Plusieurs
étapes :

Remarque :
Le
phénol a été au départ extrait de la houille. Aujourd'hui, le procédé
d'obtention fait appel aux pétroles comme substance naturelle (procédé au cumène)
- Synthèse au laboratoire :
Elle
consiste à obtenir l'aspirine par acétylation de l'acide salicylique
c'est-à-dire la dernière étape de la synthèse industrielle ci-dessus mais avec
d'autres conditions opératoires :
1-4) Dans le
langage des chercheurs :
L'utilisation
du mot synthèse est alors plus restrictive, on exclut les "synthèses
industrielles" par exemple qu'on désigne plutôt par "préparations ou
productions industrielles".
On se
concentre sur le cœur du problème qui est d'arriver à une molécule M à partir
d'une molécule M0.
En
général il s'agit de préparer de grosses molécules comme certains médicaments
en plusieurs étapes, souvent très nombreuses M0 -> M1
-> M2 -> M3 -> …… -> Mn ->M.
Le
chimiste procède au préalable à une analyse par rétrosynthèse dont le principe
est le suivant :
L'idée
de base est de partir de la molécule M qu'on souhaite préparer pour
élaborer une voie de synthèse.
On cherche dans les bases de données la (ou les) molécule(s) Mn permettant
en une étape d'obtenir M puis la (ou les) molécule(s) permettant d'obtenir Mn et ainsi de suite jusqu'à M0 molécule de départ
M0
<= M1 <= M2 <= M3 <= ……
<= Mn <=M
Parmi les
voies trouvées le chimiste doit ensuite choisir, en fonction du prix de
revient, donc du rendement global de la chaîne de réactions....
Un cas simple comme exemple : On
veut synthétiser l'octan-4-ol à partir de deux fragments plus petits par
exemple à 4 carbones chacun.
![]()
La position la plus favorable pour créer une liaison C-C (position stratégique)
semble être C4-C5, car on sait qu'un organomagnésien peut agir sur un aldéhyde
pour donner un alcool.
L'analyse rétrosynthétique de cette synthèse va s'écrire:
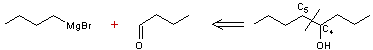
Cet exemple est une synthèse à une étape mais la plupart du temps plusieurs
étapes sont nécessaires.
C'est Corey Professeur à
Harvard et Prix Nobel 1990 qui a conçu cette technique.
Notion
de synthons (building blocks):
Corey a introduit la notion de synthon qui correspond à une partie fictive de
la molécule à synthétiser qui a des équivalents réels ; l'un de ces équivalents
peut réagir avec un des équivalents réels d'un autre synthon pour donner la
molécule recherchée.
Dans l'exemple de l'analyse rétrosynthétique de l'octan-4-ol ci-dessus on peut,
pour fabriquer cette molécule penser à deux synthons :

La mise
au point des conditions expérimentales (température, pression, catalyseur,
temps de réaction) dans un souci d'optimisation du rendement et donc du coût et
des conséquences sur l'environnement fait partie intégrante du mot synthèse.
Remarque :
Le
principe même de l'analyse rétrosynthétique laisse entrevoir que pour arriver à
une molécule complexe, il existe plusieurs molécules de départ.
Le
schéma qui suit est un exemple de ce qui a été trouvé lors des tentatives de
synthèse du paclitaxel (Taxol) ; découvert en 1971 par les chimistes Wani, Wall
et Taylor, le paclitaxel est une substance naturelle que l'on extrait de
l'écorce du tronc d'un if du pacifique (taxus brevifolia) où elle existe
à raison de 0,02%. Elle a des propriétés anticancéreuses (leucémie et une
variété du cancer du poumon) :
Voici les voies de synthèse qui ont été explorées et les précurseurs
correspondants :

2) Synthèses totales et synthèses partielles
2-1) Dans
l'histoire :
|
|
Une
synthèse totale désigne aux débuts de la chimie l'obtention d'une molécule à
partir de corps simples correspondant aux éléments chimiques qui la constituent
; on retrouve la définition académique du mot synthèse au travers de
l'acétylène. On
peut aussi citer la synthèse de l'eau que Lavoisier a réalisée en 1785 à
l'aide d'un eudiomètre, en faisant jaillir une étincelle au cœur d'un mélange
d'hydrogène et d'oxygène.
|
2-2) De nos
jours :
- La synthèse totale d'une molécule
relativement complexe correspond à l'obtention de celle-ci à partir
d'une molécule simple. On remarque que cette définition est moins
précise et qu'elle n'impose plus qu'on parte des corps simples correspondant
aux éléments qui la constituent.
- La synthèse partielle ou
semi-synthèse ou hémisynthèse d'une molécule relativement complexe
correspond à l'obtention de celle-ci à partir d'une molécule relativement
élaborée c'est-à-dire ayant une structure peu éloignée de celle de la
molécule à obtenir ; La molécule de départ peut être une molécule existant dans
la nature.
Exemple
1
- Synthèse totale :
L'exemple
de la préparation industrielle de l'aspirine qui a été donnée dans le
paragraphe 1-2) correspond à une synthèse totale au sens
actuel ; on part de phénol
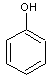
et on
aboutit à l'acide acétylsalicylique
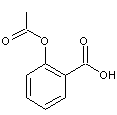
- Hémisynthèse :
Sa
préparation en laboratoire est une synthèse partielle ou hémisynthèse ; on part
de l'acide salicylique
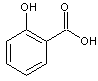
et on
aboutit à l'acide acétylsalicylique

Exemple
2
- Synthèse totale :
On
donnera l'exemple historique de la synthèse de la cortisone :
La
cortisone a été extraite en 1935 par Edward Calvin Kendall de la glande
cortico-surrénale des ruminants.
Mais
c’est Robert Burns Woodward
qui a, le premier, effectué avec son équipe sa synthèse totale, en partant de
la 2-méthoxy-5-méthylcyclohexa-2,5-diène-1,4-dione :

et en
arrivant après de multiples étapes (voir l'annexe 1) à
la molécule de cortisone :

- Synthèse partielle :
Les besoins en cortisone et corticoïdes en médecine
ont nécessité des recherches pour produire industriellement des stéroïdes avec
une fonction oxygénée en C11 qui n’est pas un point habituel de substitution
(voir annexe 7) . Une des méthodes a consisté à
convertir la diosgénine, saponine extraite des tubercules d'une plante
mexicaine (igname) du genre Dioscorea , en progestérone puis par
oxydation microbiologique (Rhizopus nigricans) avec un très bon rendement (80 à 90%) en
11-hydroxyprogestérone et finalement, après plusieurs étapes en cortisone.
On part de la diosgénine :
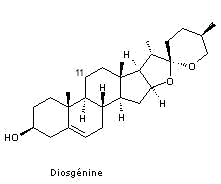
et on arrive après de multiples étapes (voir l'annexe 2) à la molécule de cortisone :

Exemple 3
- Synthèse
totale :
La synthèse totale du placlitaxel (Taxol) a nécessité
un effort de recherche majeur compte-tenu de l'importance que ce médicament a
eu dans le traitement de certains cancers et du fait de sa rareté à l'état
naturel et donc de son prix.
Plusieurs voies de recherches ont été indiquées précédemment ; pour l'une d'elles qui a eu des
développements industriels, la voie de Holton, le point de départ a été le (-)-
camphre :
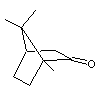
et après de nombreuses étapes, on a obtenu le
paclitaxel :

- Synthèse
partielle :
En 1989 Holton a également mis au point une
semi-synthèse du paclitaxel, en partant de la 10-désacétylbaccatine III,
composé que l'on trouve aussi dans l'if européen en plus grande quantité que le
paclitaxel lui-même :

Quelques étapes ont été nécessaires pour parvenir au
paclitaxel

3) Synthèses stéréosélectives –
synthèses stéréospécifiques :
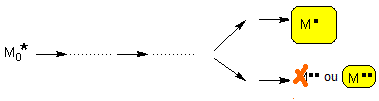
3-1) Synthèses stéréosélectives :
La définition telle qu'elle apparaît au Journal officiel du 22 septembre 2005 est la suivante :
Synthèse, ou réaction, dans laquelle un ou plusieurs
nouveaux éléments de chiralité sont formés dans une molécule substrat et qui
conduit à des proportions inégales de produits stéréo-isomères : énantiomères (synthèse
énantiosélective) ou diastéréo-isomères
(synthèse diastéréosélective).
Schématiquement on peut, en simplifiant, résumer cette
définition :
|
|
|
Exemple de synthèse
diastéréosélective :
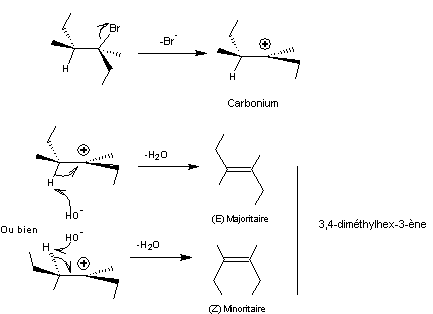
Pour obtenir le
(E)-3,4-diméthylhex-3-ène, on peut traiter le 3-bromo-3,4-diméthylhexane par
une base forte (voir mécanisme à l'annexe 5)
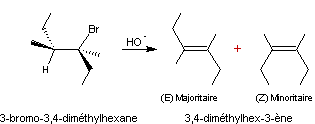
Les deux molécules obtenues sont des
diastéréo-isomères ; la synthèse est dite diastéréosélective.
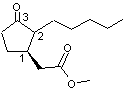
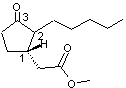
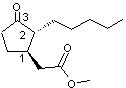
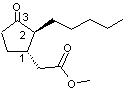
Exemple de synthèse énantiosélective : Le Paradisone®
Le dihydrojasmonate de méthyle
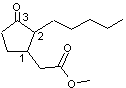
ou
3-oxo-2-pentyl-1-cyclopentaneacétate de méthyle a été découvert en 1959 par la
firme suisse Firmenich.
Cette molécule possède deux centres
stéréogènes, les carbones 1 et 2 et donc 4 stéréo-isomères (voir annexe 6).
Le mélange des 4 stéréo-isomères
constitue l'hédione® une fragrance utilisée dans un certain nombre de parfums.
L'un de ces 4 stéréo-isomères, le
(+)-1R-cis-3-oxo-2pentyl-1-cyclopentaneacétate de méthyle a une odeur fraîche
plus agréable et plus intense que les autres ; cette molécule a été synthétisée
et brevetée en 1962 et baptisée Paradisone®.
Le schéma de synthèse de cette
molécule est le suivant :
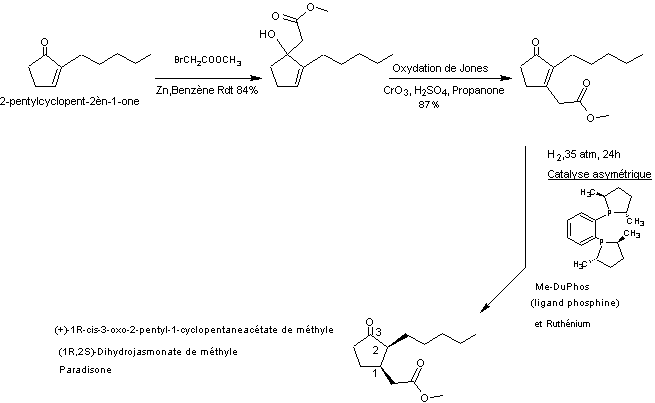
Le rapport diastéréo-isomérique de
cette synthèse :
Cis ((1R,2S)
+ (1S,2R)) / Trans ((1S,2S) + (1R,2R)) = 98/2
Cela signifie qu'on ne recueille
pratiquement que les isomères cis (98cis pour 2 trans)
Le rapport énantiomérique :
Cis ((1R,2S)) / Cis ((1S,2R)) =
85/15
Cela signifie que sur 100 molécules
cis obtenues, 85 sont (1R,2S) et 15 (1S,2R).
Cette synthèse est donc bien
énantiosélective.
3-2)
Synthèses stéréospécifiques :
Une synthèse est stéréospécifique
si, un ou plusieurs nouveaux éléments de chiralité étant formés dans une
molécule substrat, l'un des stéréo-isomères est obtenu exclusivement ou très
majoritairement et si, en remplaçant au cours de la même synthèse le substrat
par un de ses stéréo-isomères, c'est un autre stéréo-isomère de la molécule
d'arrivée qui se forme.
|
Mais aussi
|
|
Exemple de synthèse
énantiospécifique :
Pour obtenir l'acide malique on peut
hydrolyser en milieu basique l'acide chlorosuccinique.
En hydrolysant l'acide
(S)-(-)-chlorosuccinique par une solution d'hydroxyde de potassium on obtient seulement
le stéréoisomère (R) de l'acide malique qui est dextrogyre.
L'équation s'écrit (en milieu
basique on a la base conjuguée des deux acides) :

C'est bien une réaction
stéréospécifique puisqu'on n'obtient qu'un des deux stéréo-isomères et que si
on part de l'acide (R)-(+)-chlorosuccinique, seul l'acide (S)-(-)-malique se
forme.

Cette réaction est historique car
c'est elle qui a permis à Walden de mettre en évidence l'inversion de la
configuration (qui a ensuite porté son nom) lors d'une substitution nucléophile
de type SN2 (voir mécanisme à l'annexe 3).
Exemple de synthèse
diastéréospécifique :
Pour obtenir le 2,3-dibromobutane,
on fait réagir le dibrome dans CCl4 sur le but-2-ène.
-
Si le substrat de départ est le (E)-but-2-ène :
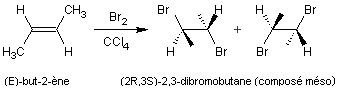
On obtient deux molécules identiques
(2R,3S)-2,3-dibromobutane à l'exclusion des stéréo-isomères (2R,3R) et (2S,3S).
-
Si le substrat de départ est le (Z)-but-2-ène (un diastéréo-isomère du substrat
précédent) :
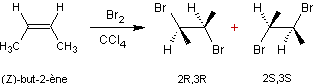
On obtient les stéréo-isomères
(2R,3R) et (2S,3S)-2,3-dibromobutane à l'exclusion du composé méso (voir
mécanisme à l'annexe 4)
Il s'agit bien d'une réaction
d'addition diastéréospécifique.
Remarque :
Toutes les synthèses
stéréospécifiques sont stéréosélectives, mais le contraire n'est pas vrai.
Synthèse
totale de la cortisone par Woodward :


Synthèse partielle de la cortisone à
partir de la diosgénine
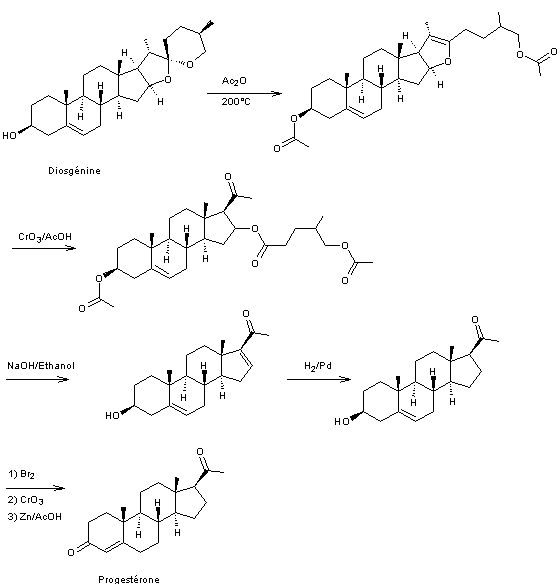
Puis
oxydation microbiologique :


Remarque :
L'approvisionnement
en diosgénine étant aléatoire, il a fallu se tourner vers une source de matière
première plus durable :
le β-sitostérol
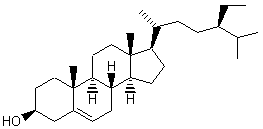
constituant
40% des
stérols extraits des tourteaux de soja.
Le
traitement par un mycobactérium coupe la chaîne en C17 ….
Mécanisme de la substitution SN2
On prend l'exemple de l'hydrolyse de
l'acide (S)-(-)-chlorosuccinique en milieu basique qui conduit à l'acide
(R)-(+)-malique seulement.
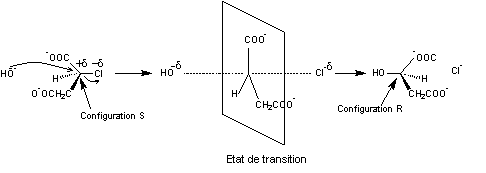
La polarisation de la liaison C-Cl
fait que le carbone lié à l'atome de chlore est partiellement privé d'électrons
et chargé positivement il sera attaqué par les réactifs nucléophiles comme
l'ion HO- . Ce réactif s'approchera de la molécule mais du côté
opposé au Cl.
Son approche repousse les électrons
de la liaison C-Cl vers le chlore et fait s'éloigner celui-ci de la molécule.
La molécule arrive à un état de transition où le substituant est déjà attaché
au carbone tandis que le groupe à substituer n'est pas encore totalement
détaché.
La structure de l'état de transition
est celui indiqué sur la figure, le carbone et ses 3 substituants sont dans un
plan tandis que les atomes HO C et Cl sont alignés perpendiculairement au plan.
Puis la molécule se retourne comme
un parapluie dans le vent, c'est l'inversion de Walden.
Mécanisme de l'action du dibrome
dans CCl4 sur le (Z)-but-2-ène

Mécanisme de l'action d'une base
forte sur le 3-bromo-3,4-diméthylhexane
Il s'agit d'une réaction
d'élimination monomoléculaire dite E1.
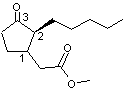
Stéréo-isomérie du dihydrojasmonate
de méthyle
Les 4 stéréo-isomères du
dihydrojasmonate de méthyle sont les suivants :
|
1R |
1S |
|
2R |
2S |
On peut les grouper de la manière
suivantes :
|
1R,2S |
1S,2R |
Les couples (1R,2S) et (1S,2R)
constituent un couple d'énantiomères. Ce sont les composés cis
c'est-à-dire que les H des carbones 1 et 2 sont du même côté du plan moyen du
cycle. |
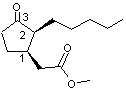
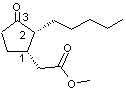
|
|
|
Les couples (1R,2R) et (1S,2S)
constituent un couple d'énantiomères. Ce sont les composés trans
c'est-à-dire que les H des carbones 1 et 2 sont de part et d'autre du plan
moyen du cycle. |
|
1R,2R |
1S,2S |
|
Numéros des sommets dans les
stéroïdes