BIOLUMINESCENCE
– CHIMIOLUMINESCENCE
Jacques
BARON
Plan
de l'étude
A – Définition
B – Les systèmes
luciférine – luciférase
2- Varguline
3- Luciférine
des dinoflagellés
6- Luciférine
des vers luisants
1- Aequorine
2- Vue
générale sur les photoprotéines
D – Luminescence
des champignons
E – Conclusion
F - Prix Nobel pour des études sur la bioluminescence
G - Rôle de la bioluminescence chez
certains animaux
A – Définition
B – Luminescence
mettant en jeu peroxydes et dioxétanone
1- Luminol
3- Acridinium
C – Luminescence
mettant en jeu des radicaux
D – Luminescence
mettant en jeu l'oxygène singulet
E - Conclusion
A – Définition :
La
bioluminescence est la production et l'émission de lumière par un être vivant.
La
cause de ce phénomène repose sur deux principes distincts
- Le système
luciférine-luciférase
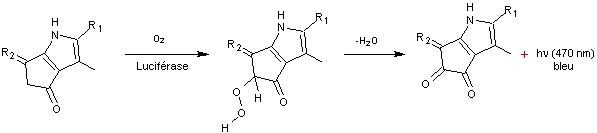
Dans ce
cas, le phénomène résulte de l'oxydation d'une molécule appelée luciférine en
présence d'un catalyseur appelé luciférase.
Ce
catalyseur est une enzyme, donc une protéine.
Il
existe plusieurs types de luciférines associées à diverses luciférases en
fonction des espèces concernées.
On
s'intéressera aux six principales luciférines connues actuellement.
- Les photoprotéines
Ce sont
des protéines donnant lieu à une émission de lumière par un procédé non
enzymatique (il n'y a pas de luciférase).
Ces cas
sont moins bien connus et peut être moins répandus.
B – Les systèmes luciférine – luciférase :
1-1 - Des cnidaires, comme l'Aequorea
(une méduse) ou la Renilla (un anthozoaire qui a la forme d'une petite
raie),
- des
cténaires, animaux ressemblant à des méduses mais non urticants,
- des
céphalopodes (certains calmars),
- des
copépodes (petits crustacés),
- des
radiolaires (protozoaires),
possèdent
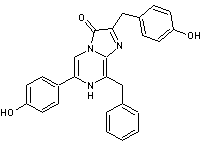
des luciférines dont le type est la coelentérazine.
La
coelentérazine tire son nom des coelentérés, terme aujourd'hui disparu de la
classification au profit de cnidaires et cténaires.
La
formule de la coelentérazine est :
Pour
alléger l'écriture, on adopte une représentation de la molécule ne laissant
apparaître que la partie qui sera affectée.
1-2 En présence de luciférase des transformations de la molécule ont lieu :
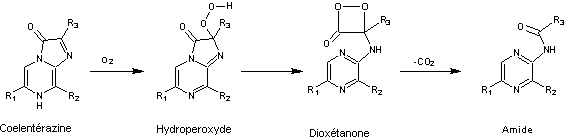
Remarquez
la présence d'un hydroperoxyde et d'une dioxétanone comme intermédiaires.
On
aboutit à la coelentéramide, un
dérivé de la coelentérazine correspondant à l'ouverture du cycle pentagonal,
dont la formule complète est :
Lors du
départ de CO2, la coelentéramide se trouve dans un état excité. Le
retour à l'état stable s'accompagne d'une libération d'énergie qui se traduit
par l'émission d'une lumière bleue (460<λ<480nm).
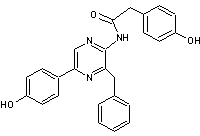
2- Varguline
C'est
une luciférine qu'on trouve chez certains crustacés ostracodes (Vargula)
et chez des poissons des grandes profondeurs.
Le
mécanisme est le même que celui de la coelentérazine.
On
trouve en effet, en ce qui concerne la partie de la molécule qui est affectée,
les mêmes structures, avec mise en place d'une fonction amide –CO-NH- à la
place du cycle imidazolone
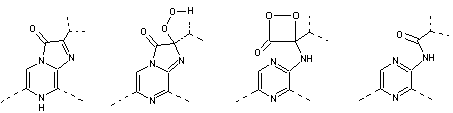
3- Luciférine des
dinoflagellés
3-1 Les
dinoflagellés sont des protozoaires munis d'un flagelle comme leur nom
l'indique.
En
nombre considérable, ils sont généralement responsables de territoires lumineux
à la surface des océans la nuit. Ce sont les noctiluques du plancton.
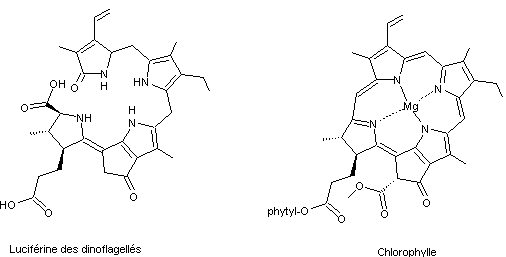
Leur
luciférine est une molécule qui ressemble à celle de la chlorophylle :
3-2 En se
limitant à la partie de la formule utile aux explications, où le noyau pyrrole
a un côté commun avec un autre noyau pentagonal (en bas à droite de la figure),
on peut mettre en évidence qu'à l'air il se forme un produit d'oxydation avec
un hydroperoxyde comme intermédiaire.
4-1 Ces bactéries
se retrouvent dans des animaux de grande taille (calmars, poissons, ….) qui les
ont consommés et peuvent leur communiquer une certaine luminosité.
Le
processus est une oxydation par l'oxygène mais il se complique du fait qu'il
fait intervenir une luciférine accompagnée d'un co-facteur ; ici un aldéhyde.
4-2 La luciférine
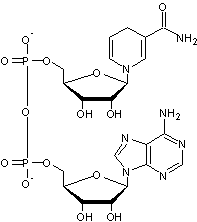
est la forme réduite d'une flavine nucléotide.
Rappelons
ici l'origine de la structure d'une telle molécule :
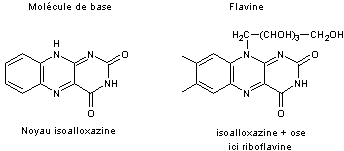
L'acide
phosphorique donne la riboflavine-phosphate encore appelée flavine
mononucléotide (FMN) :
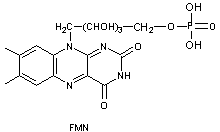
La luciférine
est la flavine mononucléotide réduite (FMNH2) :
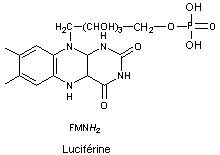
On remarquera
son oxydation qui correspond au départ de 2H qui étaient fixés, chacun sur 1N
de chaque noyau azoté.
4-3
L'équation-bilan de la bioluminescence s'écrit :
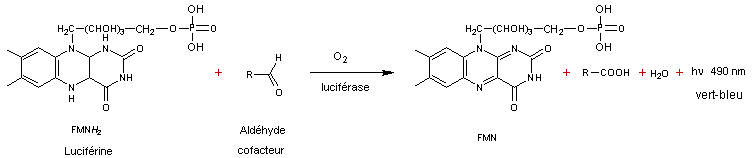
Il doit se
former un hydroperoxyde
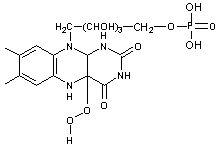
qui oxyde
l'aldéhyde.
Latia
neritoides est un gastéropode
d'eau douce, à coquille conique évasée (famille des patelles).
Sa luciférine
est un ester de l'acide formique (méthanoïque) :
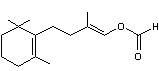
La réaction conduisant
à la luminescence, nécessite la présence d'un co-facteur donneur d'hydrogène
qui est mal connu et désigné ici par AH2.
Equation-bilan
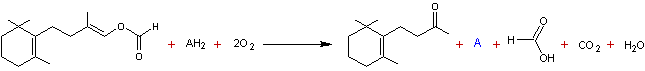
Cette
réaction peut donc être comparée à celle vue précédemment avec les bactéries luminescentes, mais ici le
co-facteur AH2 serait de nature protéinique et, après oxydation, A
comporterait une fonction cétone.
6- Luciférine des
vers luisants
6-1 Ver est une
appellation incorrecte pour désigner ces insectes coléoptères, lucioles et
lampyres, espèces très voisines, souvent confondues. Le ver luisant le plus
connu est la femelle du lampyre. Ces animaux ont le plus souvent des dimensions
de l'ordre du centimètre. On observe un point lumineux très brillant,
jaune-verdâtre dans une prairie ou un jardin. Mais Pyrophorus noctilus
est un gros coléoptère dont les Indiens se servaient pour éclairer leurs cases.
6-2 La formule de
la luciférine est :
Les étapes de
la réaction de bioluminescence, assez complexes, sont maintenant bien connues.
Le processus nécessite de l'ATP et des ions Mg2+.
La luciférine
est transformée en
Il y a
émission d'une lumière vert-jaune.
6-3 Détaillons
les étapes :
Rappel et
notations
Les
explications feront appel :
- à l'ATP (adénosine triphosphate)
Cette molécule
est bien connue comme étant indispensable à la réalisation d'un grand nombre de
processus biologiques
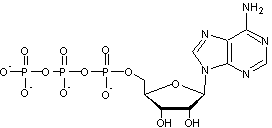
- à l'AMP (adénosine monophosphate)
Formule
analogue à l'ATP avec deux groupements phosphoriques en moins.
- à l'ion pyrophosphate
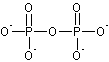
cet ion P2O74-
sera noté Pr
Pour alléger
l'écriture nous ne représenterons que la partie de la molécule de luciférine
qui subit des transformations (à droite sur la figure)
Le carbone du
cycle qui porte la fonction –COOH est un carbone asymétrique de configuration
(S).

6-4 Application :
dosage de l'ATP
L'ATP étant
un composé fondamental de la matière vivante, régulant les échanges d'énergie
dans la grande complexité des réactions biochimiques, l'intérêt de ce dosage
est évident.
On utilise de
la luciférine et il existe des relations entre l'intensité lumineuse émise et
la concentration en ATP.
1- Aequorine
La
coelentérazine de la méduse Aequorea peut donner lieu à une émission de
lumière en l'absence d'enzyme mais par contre en présence de calcium.
1-1 On a fait une
étude in-vitro
La coelentérazine
s'associe à une protéine ; l'ensemble a été nommé "aequorine". En
présence de Ca2+, la conformation de la protéine se modifie. Trois
ions Ca2+ se fixent sur des sites privilégiés de la protéine. On a
donc un complexe coelentérazine – protéine - Ca2+.
L'oxygène
est amené à réagir sur la coelentérazine ; on aboutit à la coelentéramide sous
forme excitée comme dans le cas où le processus est enzymatique, avec les mêmes
intermédiaires : hydroperoxyde, dioxétanone (voir
partie B – coelentérazine).
Le
retour à l'état stable de la coelentéramide s'accompagne d'une émission de
lumière
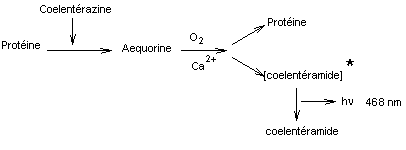
1-2 Cette étude in-vitro donne une lumière bleue
(λ = 468 nm)
La
lumière de la méduse n'est pas bleue mais verte parce qu'in-vivo il y a un
autre passage du complexe coelentérazine – protéine – calcium, appelé BFP (blue
fluorescent protein) à un complexe comportant une autre protéine, appelé GFP (green
fluorescent protein). Il en résulte la libération d'une quantité d'énergie un
peu plus faible ; la longueur d'onde est de l'ordre de 500 nm (vert).
1-3 Application
Cette
bioluminescence permet de faire des mesures de Ca2+ libre dans les
cellules vivantes.
2-Vue générale sur
les photoprotéines
D'une
façon générale les photoprotéines peuvent être considérées comme des
hétéroprotéines dont le groupement
prosthétique – une luciférine – est un chromophore.
En
l'absence de luciférase, après une phase d'oxydation, ce dernier se détache à
l'état excité.
Un
retour à l'état stable engendre un départ d'énergie sous forme lumineuse.
Sont
luminescents grâce à des photoprotéines diverses espèces de méduses (Aequorea),
de mollusques lamellibranches (pholades), d'annélides (vers polychètes), ….
D – Luminescence des champignons
Un
certain nombre de champignons supérieurs sont lumineux.
Leur
lueur est faible mais peut se voir dans un bois la nuit.
La
plupart sont de la famille des mycènes, mais on trouve aussi des marasmes et
des armillaires.
Les
résultats des études ne sont pas encore très nombreux.
Leur
luciférine aurait un précurseur, molécule appelée panal (de Panellus
stipticus, un mycène) :
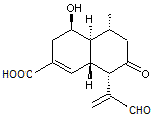
Il est
accompagné d'un co-facteur, le NADH (nicotinamide – adénine –dinucléotide
hydrogéné)
NB : nucléotide = base organique
azotée + ose + H3PO4
On
reconnaît la nicotinamide
et l'adénine. C'est
la nicotinamide qui est hydrogénée.
E – Conclusion
1- De nombreuses espèces n'ont pas
été citées.
L'exploration
du monde sous-marin ne fait que commencer.
La
connaissance de mécanismes faisant souvent intervenir des hydroperoxydes et la
structure dioxétanone
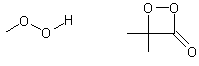
a
incité les chercheurs à s'intéresser à la luminescence de molécules organiques
à caractère non biologique.
La
bioluminescence est la chimiluminescence des réactions biochimiques.
F – Prix Nobel pour des études sur la bioluminescence
En 2008
trois chercheurs se sont vus attribués le Prix Nobel de Chimie pour leurs
travaux sur la bioluminescence ; ce sont
- SHIMOMURA Osamu
Il
étudie la bioluminescence de la méduse Aequorea victoria qui avait été
remarquée quelques années auparavant et met en évidence, en 1962, deux
protéines à l'origine de cette fluorescence : l'aequorine et la GFP (Green
Fluorescent Protein). Entre 1969 et 1971, il décrit, avec son équipe, le
mécanisme de cette luminescence.
- CHALFIE Martin
Il a
l'idée d'utiliser dans les années 1990 la GFP (Green Fluorescent Protein) mise
en évidence dès 1962 par l'équipe du Professeur Osamu Shimomura comme marqueur
biologique pour dresser la carte du Caenorhabditis elegans un ver
microscopique qui sert de modèle en génétique et qui est transparent.
- TSIEN Roger
Avec
son équipe il met en évidence le rôle de l'oxygène dans le mécanisme de la
fluorescence de la GFP (Green Fluorescence Protein) découverte par Shimomura
dans les années 1960. Il modifie la structure biochimique de cette protéine
afin de lui faire émettre de la lumière fluorescente dans une large gamme de
couleurs (du bleu au jaune) élargissant ainsi la
palette des marqueurs luminescents.
G – Rôle de la bioluminescence chez certains animaux
On
attribue quatre fonctions principales à ce phénomène chez certains animaux :
- l'éclairage
- l'attraction des proies
- la protection contre les
prédateurs
- la communication.
CHIMIOLUMINESCENCE ou
chimiluminescence.
A – Définition
1- On appelle
chimioluminescence l'émission de lumière produite par une réaction chimique.
Plus
précisément, certaines molécules portées à un état excité reviennent à un état
stable en restituant de l'énergie sous forme de lumière.
Il
existe différentes manières de provoquer l'émission de lumière ; par exemple,
certaines molécules irradiées par des ultraviolets émettent de la lumière
visible.
Si
l'excitation est due à une réaction chimique, cette émission est appelée
chimioluminescence.
2- Les mécanismes de la
chimioluminescence ont d'abord été étudiés sur des réactions de biochimie. La
bioluminescence, de plus en plus explorée, concerne la production de lumière
par toutes sortes d'organismes vivants. L'étude des réactions de
bioluminescence a conduit à s'intéresser à la chimioluminescence de façon
générale.
3- La plus connue des
réactions chimiques avec émission de lumière est l'oxydation du phosphore blanc
à l'air.
En 1913
on découvre la luminescence du luminol quand on l'oxyde en milieu basique par
l'eau oxygénée ou l'eau de Javel.
Puis on
constate que la décomposition de certains peroxydes s'accompagne d'une
luminescence. Mais en général l'intensité observée est très faible.
4- Actuellement, une étude
systématique montre que la chimioluminescence repose sur trois principes de
base possibles :
- Soit la présence comme intermédiaire de peroxydes et
d'une structure dioxéthanone dont la décomposition produit des molécules
excitées
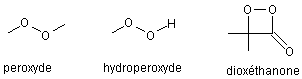
- Soit l'existence de radicaux
- Soit la présence d'oxygène singulet, structure
électronique particulière de la molécule O2 qui apparaît dans
certaines réactions.
5- Si le phénomène lumineux
cesse dès que la cause disparaît, il y a fluorescence.
Si le
phénomène lumineux persiste un certain temps (quelques minutes, plusieurs
heures, ….) après disparition de la cause, on parle de phosphorescence.
On
explique ce retard par la difficulté qu'aurait le système à retrouver un état
stable, notamment à cause de retournements de spins d'électrons.
NB : L'oxydation du
phosphore blanc à l'air ne dure que tant qu'il reste du phosphore. C'est une
luminescence, improprement appelée phosphorescence dans le langage courant.
B – Luminescence mettant en jeu peroxydes et dioxéthanone
1- Luminol
1-1 Le luminol
est oxydé par l'eau oxygénée en milieu basique.
Equation-bilan
:
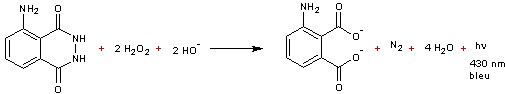
En
pratique l'oxydation ne se fait à vitesse appréciable que si la réaction est
catalysée par Fe3+ ou mieux encore, Fe(CN)63-
1-2 Le luminol
est connu depuis longtemps ; le mécanisme de l'oxydation a été élucidé
La
décomposition de l'eau oxygénée engendre des radicaux HO.
![]()
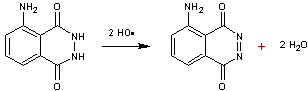
Mais
l'eau oxygénée réagit sur cette molécule

Dans
l'avant dernière étape du mécanisme, un réarrangement de l'oxygène après départ
d'azote conduit à un composé excité
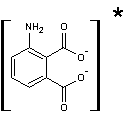
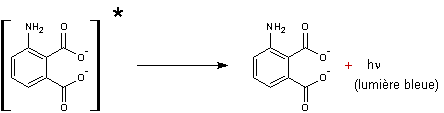
La désexcitation
est responsable de l'émission de lumière soit :
1-3 Application
Le
luminol sert à détecter les traces de sang, notamment dans les enquêtes sur les
crimes.
On vaporise
un mélange de luminol et d'eau oxygénée sur la surface à étudier. Le fer Fe2+
de l'hémoglobine est transformé en Fe3+ par l'eau oxygénée et sa
présence assure la catalyse de la réaction de luminescence. Il se produit une
lueur bleue assez fugitive.
2-1 L'oxalate de
diphényle est oxydé par l'eau oxygénée
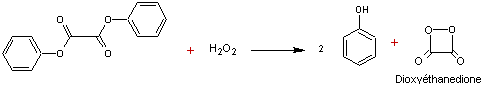
Le
dioxyéthanedione se décompose spontanément en CO2 en produisant de
l'énergie.
Si le milieu
réactionnel est additionné d'un colorant approprié (fluorophore), ce dernier
peut capter l'énergie, ce qui lui donne un état excité. La molécule de colorant
se désexcite en émettant de l'énergie lumineuse. C'est un phénomène de
fluorescence
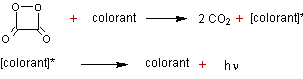
2-2 On a essayé
plusieurs dérivés de l'oxalate de diphényle et toute une série de colorants
fluorophores. Une qualité essentielle de la molécule d'un bon colorant
fluorescent est de posséder un grand système de doubles liaisons conjuguées. Il
s'agit de molécules à noyaux aromatiques condensés ou de molécules cycliques
planes possédant des liaisons π.
La
couleur de la lumière dépend du fluorophore. Citons quelques fluorophores, avec
indication de la lumière fluorescente produite :
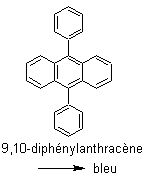
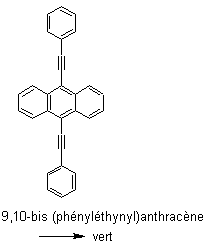
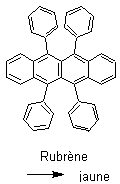
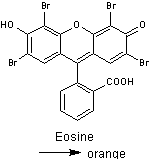
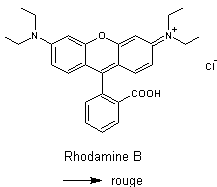
NB : Ne pas confondre
la couleur du produit et la fluorescence. Par exemple, le rubrène est rouge ;
il donne une fluorescence jaune.
2-3 Application
Les
bâtons lumineux.
Ils
sont appelés assez souvent "tubes cyalume®".
Dans un
tube flexible en matière plastique on introduit de l'oxalate de diphényle, un
fluorophore et une ampoule de verre contenant de l'eau oxygénée.
En
fléchissant le tube, on casse l'ampoule, le mélange réactionnel se fait et le
bâton devient lumineux.
Suivant
les quantités de réactifs en présence, on peut obtenir une émission intense
mais de courte durée ou une émission plus faible mais qui dure longtemps.
Les tubes
de grande taille sont employés comme éclairage de secours.
On peut
aussi donner aux tubes diverses formes pour en faire des objets décoratifs
(bracelets, colliers, ….).
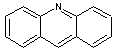
3- Acridinium
3-1 La
fluorescence peut se manifester avec des composés de l'acridine.
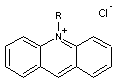
Mais
sous la forme acridinium, les résultats sont plus satisfaisants.
Exemple
de sel d'acridinium
D'ailleurs,
les réactions envisagées nécessitent un milieu basique ; on conçoit qu'on passe
d'une forme à l'autre facilement.
Enfin,
les molécules les plus connues susceptibles de donner lieu à fluorescence sont
des esters : des acridinium-9-carboxylates.
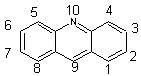
Remarque : Il est utile de noter la numérotation
traditionnelle des sommets de l'acridine :
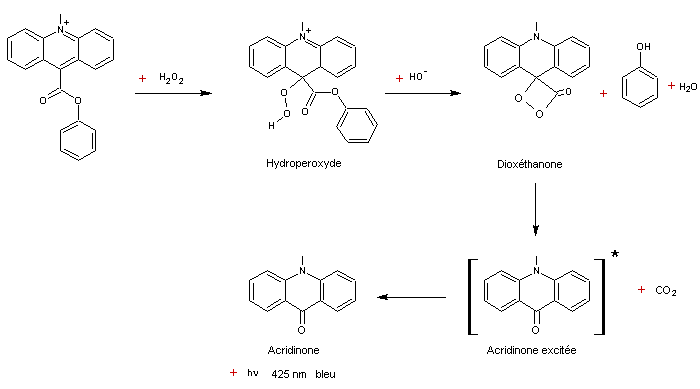
3-2 Considérons l'oxydation
par l'eau oxygénée du N-méthyl acridinium -9- carboxylate de phényle
Mais
l'acridinone excitée peut également céder son énergie à un fluorophore par
exemple la rhodamine B
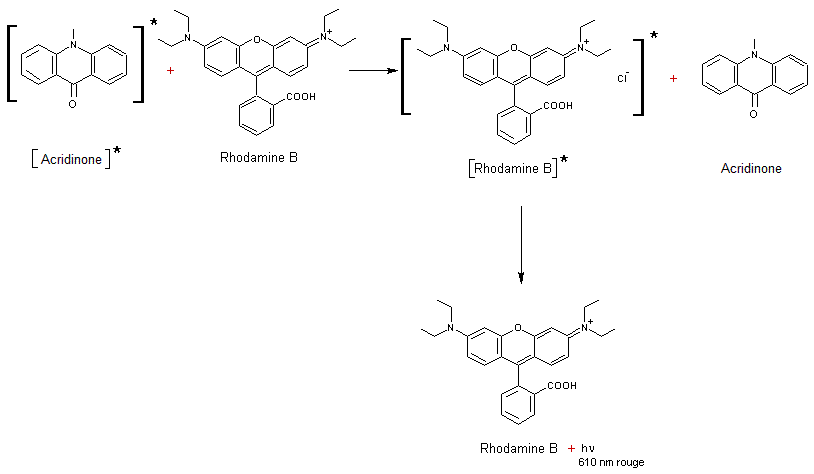
On
rappelle que c'est le fluorophore qui impose la longueur d'onde de la lumière
émise.
3-3 Application
Grâce à
la fluorescence, des composés acridiniums peuvent servir au suivi d'une
protéine.
Par
exemple avec
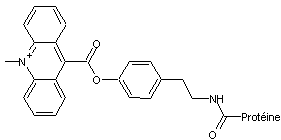
liée à
un anticorps, on peut faire des dosages immunologiques en réalisant la réaction
dans un fluoromètre.
C – Luminescence mettant en jeu des radicaux
1-1 Le monoxyde
d'azote NO de l'atmosphère peut-être dosé dans un analyseur où on injecte de
l'ozone, en mesurant l'intensité lumineuse de la réaction

1-2 On peut
également détecter des explosifs nitrés (TNT,….) sous forme d'aérosols, après
leur avoir fait subir une pyrolyse.
En
représentant très schématiquement un explosif nitré par R-NO2
![]()
.NO2 est la
formule classique du dioxyde d'azote. Elle comporte un électron célibataire
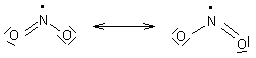
.NO2 est
évidemment écrit NO2.
On
réduit NO2 en NO en utilisant du molybdène comme catalyseur et on procède
comme indiqué au début du paragraphe (action de O3) pour avoir NO2*
1-3 On conçoit
qu'on peut mesurer la quantité totale de NO et de NO2 de
l'atmosphère en opérant en deux temps sur le mélange : sans réduction et avec
réduction.
Le
phosphore a été découvert au XVIIème siècle.
On sait
que l'oxydation lente du phosphore blanc s'accompagne d'une fluorescence
verdâtre, visible dans l'obscurité.
Pourtant,
le mécanisme de ce phénomène est encore mal connu. L'hypothèse la plus souvent
avancée met en jeu des radicaux oxygène O.
D – Luminescence mettant en jeu l'oxygène singulet
1- Qu'est-ce que l'oxygène
singulet ?
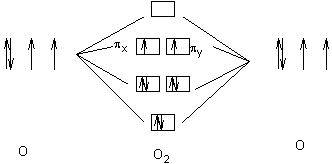
1-1 La formule
électronique de l'oxygène est 1s2
2s2 2p4
La
molécule de O2 dans son état stable habituel n'a pas la structure
![]()
qu'on
peut imaginer.
Le
paramagnétisme de l'oxygène oblige à considérer que la molécule comporte deux électrons
à spins parallèles.
Diagramme
des orbitales au niveau 2p :
On peut
adopter la représentation
![]()
On dit
que la molécule O2 est dans un état triplet parce que, à cause des
spins s = +1/2 et s = +1/2 des électrons des orbitales πx et
πy, la quantité 2s + 1 de la règle de quantification, est égale
à 3. Et on adopte la notation (3)O2.
1-2 Ceci dit, certaines
réactions produisent de l'oxygène moléculaire dans un état différent de
celui-ci ; on a
![]()
Sa
durée de vie est très courte (état instable)
Mais
aussi et surtout
![]()
état
métastable, avec possibilité de réagir dans des conditions appropriées.
On dit
que cette molécule O2 métastable est dans un état singulet parce
que, à cause des spins s = +1/2 et s = -1/2, la quantité 2s + 1 est égale à 1.
Et on adopte la notation (1)O2.
Au bout
d'un temps plus ou moins long, par collision de deux molécules
![]()
Rappelons
que (3)O2 est l'oxygène ordinaire.
2- On connaît plusieurs
sources d'oxygène singulet. Citons-en deux
- En faisant barboter du chlore dans de l'eau oxygénée
en milieu basique
![]()
On peut
faire un mélange d'eau de Javel et d'eau oxygénée, le résultat est le même
![]()
- Par décomposition de peracides
![]()
3- Il
est possible d'accroître l'intensité lumineuse de façon significative en
faisant en sorte que l'énergie émise à partir de l'état singulet soit
communiquée à certaines molécules aptes à la recevoir.
C'est
le cas de la dibenzanthrone, appelée violanthrone
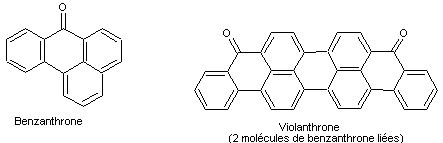
Désignons
par V cette molécule
E – Conclusion
La
chimioluminescence, phénomène peu courant, il faut le reconnaître, se montre
quelquefois utile.
C'est le cas
par exemple de la détection ou du dosage de quelques substances, d'effets
lumineux décoratifs et même d'éclairage de secours.
1)
Préparations de l'oxalate de diphényle
2
méthodes :
- Acide oxalique sur phénol
avec catalyseur
On
dissout 1 mol. d'acide oxalique dans de l'acide sulfurique à la concentration
de 3 mol/L.
On
dissout 2 mol. de phénol dans de l'acide sulfurique à la concentration de 3
mol/L.
On
mélange les deux solutions.
La réaction
est la suivante :
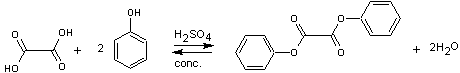
Cette
réaction est réversible. Le rendement est faible et la séparation de l'oxalate
de diphényle difficile.
- Le dichlorure de l'acide
oxalique sur le phénol
·
Préparation du chlorure d'acyle :
Dans un
environnement parfaitement anhydre mettre de l'acide oxalique dans un ballon
plongé dans un bain de glace (travailler sous une hotte).
On
ajoute par petites quantités du trichlorure de phosphore, un liquide fumant
incolore. Une fois tout le PCl3 ajouté on chauffe la solution et on
maintient un reflux durant une à cinq heures.
Durant
cette réaction le chlorure d'acyle (liquide) et l'acide phosphoreux (solide)
sont produits. On récupère le chlorure d'acyle par filtration. On rappelle que
toutes ces opérations doivent être conduites en milieu anhydre.
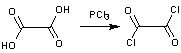
Stoechiométrie
de la réaction :
![]()
·
Préparation de l'oxalate de diphényle :
On
dissout le phénol et de la triéthylamine dans du toluène.
On
refroidit cette solution dans un bain de glace puis toujours en milieu anhydre
on ajoute le chlorure d'acyle par petites fractions.
Un précipité
se forme immédiatement après l'ajout du chlorure d'acyle, c'est de l'oxalate de
diphényle. Il faut chauffer à reflux pendant 30 minutes.
On
refroidit la solution dans un bain de glace et on filtre sous vide pour
récupérer les cristaux.
On lave
ensuite les cristaux avec de l'hexane et de l'eau et on termine par une
recristallisation dans du toluène.
Une
dernière filtration sous vide et un rinçage à l'hexane.
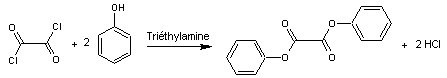
Remarque : La triéthylamine
sert seulement à capter le chlorure
d'hydrogène produit par la réaction.
2)
"Obtention de lumière froide"
On mélange l'oxalate de
diphényle dans un solvant avec le colorant, par exemple la rhodamine B (pour
obtenir du rouge).
Lorsqu'on
ajoute le peroxyde d'hydrogène, l'oxalate de diphényle se décompose en phénol
et en dioxyéthanedione, un peroxyde instable qui se décompose à son tour en
deux moles de dioxyde de carbone.
Il se
dégage l'énergie nécessaire pour activer le colorant et faire passer un
électron de sa molécule à l'état excité ; il y restera un court instant puis
reviendra à son état fondamental en libérant de l'énergie sous forme d'un
photon dont la longueur d'onde est de 610 nm ;
ce
photon dit photon de fluorescence de la rhodamine B correspond à de la lumière
rouge ; pour le rubrène un autre colorant, la fluorescence correspondrait à de
la lumière jaune (environ 570 nm)
Résumons
par des équations chimiques :
·
Action de l'oxalate de diphényle sur le
peroxyde d'hydrogène

·
L'énergie dégagée place le colorant
utilisé (ici la rhodamine B) dans un état excité
